
科目: 来源: 题型:选择题
| A. | ①③④ | B. | ②③④ | C. | ②④⑤ | D. | ①④⑤ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将5 mL 0.02 mol/L的H2SO4溶液与5 mL 0.02 mol/L NaOH溶液充分混合,若混合后溶液的体积为10 mL,则混合液的pH=2 | |
| B. | 某物质的溶液中由水电离的c(H+)=1×10-amol/L,若a>7,则pH一定为14-a | |
| C. | pH相等的①CH3COONa ②C6H5ONa ③NaHCO3溶液中,c(Na+)大小关系:①>③>② | |
| D. | CH3COONa溶液中加入少量KNO3固体后的碱性溶液一定有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加水稀释成100 mL | B. | 加入10 mL的水进行稀释 | ||
| C. | 加入10 mL 0.01 mol/L的NaOH溶液 | D. | 加入10 mL 0.01 mol/L的HCl溶液 |
查看答案和解析>>
科目: 来源: 题型:解答题
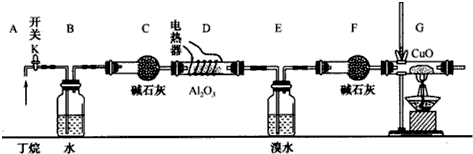

查看答案和解析>>
科目: 来源: 题型:解答题
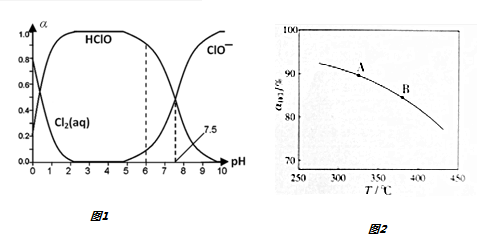
查看答案和解析>>
科目: 来源: 题型:解答题
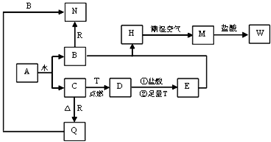 已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体.
已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体.查看答案和解析>>
科目: 来源: 题型:解答题
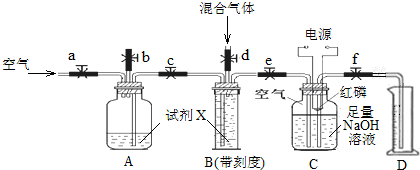
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 5.68g | B. | 7.1g | C. | 3.55g | D. | 1.42g |
查看答案和解析>>
科目: 来源: 题型:解答题
| 化学式 | 电离常数 |
| H2SO3 | K1=1.3×10-2,K2=6.2×10-8 |
| H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | NH4+,NO3-,CO32-,Na+ | B. | Na+,Ba2+,Mg2+,HCO3- | ||
| C. | NO3-,Ca2+,K+,H+ | D. | NO3-,K+,AlO2-,OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com