
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
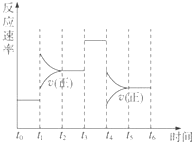 在体积固定的密闭体系中发生下列反应:
在体积固定的密闭体系中发生下列反应:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 乙烷 | B. | 乙烯 | C. | 乙炔 | D. | 酒精 |
查看答案和解析>>
科目: 来源: 题型:解答题
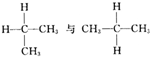
查看答案和解析>>
科目: 来源: 题型:选择题
 北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开.S-诱抗素的分子结构如图,下列关于该分子说法不正确的是( )
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开.S-诱抗素的分子结构如图,下列关于该分子说法不正确的是( )| A. | 1mol该有机物可与2mol钠反应 | |
| B. | 该有机物可以发生酯化、加成、醇催化氧化 | |
| C. | 1mol碳酸钠可与2mol该物质反应产生1mol二氧化碳 | |
| D. | 该有机物中含有碳碳双键、羟基、羧基等官能团 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1mol乙烷中含有6NA个共价键 | |
| B. | 1mol乙醇与足量乙酸在浓硫酸催化下反应可生成1mol乙酸乙酯 | |
| C. | 1mol某饱和醇(可看成是烷烃中的氢被羟基取代的产物)与足量的金属钠反应产生1molH2,说明其一个分子中含有两个羟基 | |
| D. | 1mol乙烯发生加成反应其断裂2mol共价键 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 质量数为14的碳原子的表达式:${\;}_{8}^{14}$C | |
| B. | 乙醇的结构简式:C2H5OH | |
| C. | 乙烯的结构简式为CH2CH2 | |
| D. | 甲烷分子的球棍模型: |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com