
科目: 来源: 题型:选择题
| A. | 液氨用作致冷剂 | B. | 明矾用作净水剂 | ||
| C. | 用氢氟酸刻蚀石英制艺术品 | D. | 用铁质容器盛放浓硝酸 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1:2:3 | B. | 1:3:2 | C. | 2:3:1 | D. | 3:2:1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Cu(IO3)2作氧化剂,Cu(IO3)2中的铜和碘元素被还原 | |
| B. | CuI既是氧化产物又是还原产物 | |
| C. | 每生成1 mol CuI,有12 mol KI发生氧化反应 | |
| D. | 每转移1.1 mol电子,有0.2 mol IO3-被氧化 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C2H6与C3H8没有同分异构体,CH2O2与C2H4O2属于同系物 | |
| B. | 一定条件下,乙酸乙酯、淀粉、蛋白质、乙烯都能与水发生水解反应 | |
| C. | 一定条件下,完全燃烧14g含氧质量分数为a的乙烯、乙醛混合气体,则生成水的质量为18(1-a)g | |
| D. | 全降解塑料(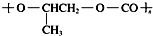 )可由单体环氧丙烷( )可由单体环氧丙烷(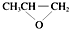 )和CO2缩聚制得 )和CO2缩聚制得 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 天津港爆炸案中对剧毒的氰化钠(NaCN) 喷洒双氧水消毒,是利用了双氧水的氧化性 | |
| B. | 碳酸钙分解、氢氧化钡晶体和氯化铵固体反应、高温下铝与氧化铁反应都是吸热反应 | |
| C. | 刚玉、红宝石主要成分是氧化铝,陶瓷、分子筛主要成分是硅酸盐 | |
| D. | 石油原油的脱水,有色玻璃、纳米材料、塑料、橡胶及合成纤维等制造过程都会用到胶体 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
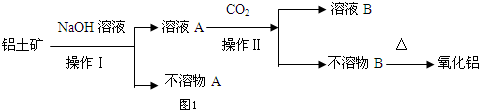
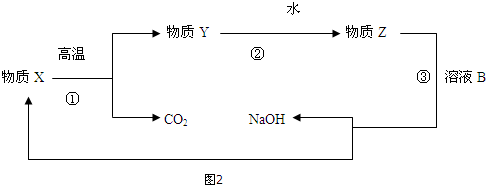
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
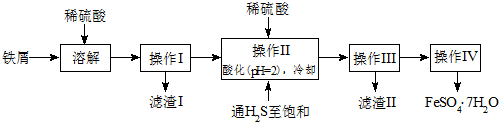
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com