
科目: 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | X单质、Y单质工业上均用电解其氧化物法得来 | |
| B. | Z、W两元素形成的不同化合物,Z的化合价一定不同 | |
| C. | Y的氧化物能与酸反应也能与碱反应,所以既是酸性氧化物又是碱性氧化物 | |
| D. | 一定条件下,W单质可以将Z单质从其氢化物中置换出来 |
查看答案和解析>>
科目: 来源: 题型:填空题
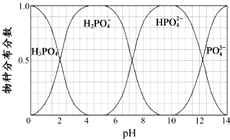 磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示.
磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示.查看答案和解析>>
科目: 来源: 题型:选择题
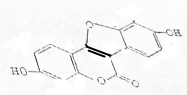
| A. | 该物质的分子式为C15H10O5 | |
| B. | 该物质中所有原子一定在同一平面内 | |
| C. | 1mol该物质最多可与5molBr2发生反应 | |
| D. | 1mol该物质最多可与3molNaOH发生反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | W>Y>Z>X | B. | Y>X>W>Z | C. | Y>X>Z>W | D. | Z>Y>X>W |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,2.24 CCl4中含有0.4NA个碳氯单键 | |
| B. | 22.4LCl2通入水中充分反应,共转移NA个电子 | |
| C. | 1 L 1 mol/L的氯化铜溶液中Cu2+的数目小于NA | |
| D. | 5.6g铁在0.1 mol氯气中充分燃烧,转移的电子数为0.3NA |
查看答案和解析>>
科目: 来源: 题型:选择题
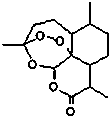 东晋医药学家葛洪的《肘后备急方•治寒热诸疟方》记载有“青蒿一握,以水二升渍,绞取汁,尽服之”的说法,说明不能加热青蒿,因高温可能使活性成分受损.中国药学家屠呦呦用沸点只有35℃的乙醚作为溶剂来提取青蒿素,创制出新型抗疟药青蒿素和双氢青蒿素,为此获得2015年诺贝尔生理学或医学奖.已知青蒿素的结构如图所示,下列有关青蒿素的说法,不正确的是( )
东晋医药学家葛洪的《肘后备急方•治寒热诸疟方》记载有“青蒿一握,以水二升渍,绞取汁,尽服之”的说法,说明不能加热青蒿,因高温可能使活性成分受损.中国药学家屠呦呦用沸点只有35℃的乙醚作为溶剂来提取青蒿素,创制出新型抗疟药青蒿素和双氢青蒿素,为此获得2015年诺贝尔生理学或医学奖.已知青蒿素的结构如图所示,下列有关青蒿素的说法,不正确的是( )| A. | 分子式为C15H22O5 | |
| B. | 能够发生水解反应 | |
| C. | 用沸点只有35℃的乙醚作为溶剂来提取青蒿素的方法化学上叫萃取 | |
| D. | 青蒿素能够治疗疟疾可能与结构中存在过氧键或酯基等基团有关 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 95℃纯水的pH<7,说明加热可导致水呈酸性 | |
| B. | pH=3的醋酸溶液稀释至10倍后pH=4 | |
| C. | 0.2 mol/L的盐酸与0.1 mol/L的盐酸等体积水混合后pH=1.5 | |
| D. | pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH<7 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 升温能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数 | |
| B. | 具有足够能量的分子(活化分子)相互碰撞就一定能发生化学反应 | |
| C. | 增大反应物浓度,可增大活化分子的百分数,从而使有效碰撞次数增大 | |
| D. | 催化剂不影响反应活化能,从而只影响反应速率不影响化学平衡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com