
科目: 来源: 题型:选择题
| A. | 氧化剂与还原剂的物质的量之比为1:6 | |
| B. | 氧化产物与还原产物的质量之比为1:1 | |
| C. | 生成3mol水时有1mol KIO3被氧化 | |
| D. | 1mol KIO3参加反应时有5mol电子转移 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 过量的NaHSO4和Ba(OH)2溶液反应:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | NaHCO3和过量NaOH溶液相混合:HCO3-+OH-═CO32-+H2O | |
| C. | NaHSO4溶液中滴加NaHCO3溶液:H++HCO3-═H2O+CO2↑ | |
| D. | 用NaOH吸收过量的CO2:CO2+OH-═HCO3- |
查看答案和解析>>
科目: 来源: 题型:解答题
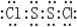 .Y2 Z2遇水很易反应,产生的气体能使品红溶液褪色,则其与水反应的化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl
.Y2 Z2遇水很易反应,产生的气体能使品红溶液褪色,则其与水反应的化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl查看答案和解析>>
科目: 来源: 题型:解答题
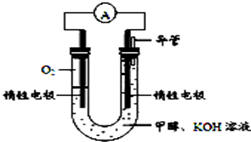 “低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
查看答案和解析>>
科目: 来源: 题型:解答题
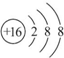
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Mg2+、Fe3+、NO3-、SCN- | B. | Al3+、Fe2+、Cl-、SO42- | ||
| C. | K+、Na+、Cl-、HCO3- | D. | Na+、Ca2+、NO3-、OH- |
查看答案和解析>>
科目: 来源: 题型:解答题
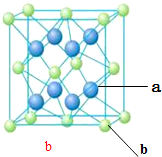 X、Y、Z、M、N、Q为元素周期表前四周期的六种主族元素.其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1,Q在元素周期表的各元素中电负性最大.请回答下列问题:
X、Y、Z、M、N、Q为元素周期表前四周期的六种主族元素.其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1,Q在元素周期表的各元素中电负性最大.请回答下列问题: .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
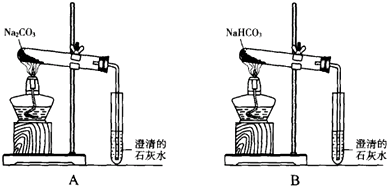
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com