
科目: 来源: 题型:解答题
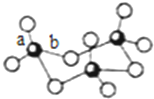 硫及其化合物广泛存在于自然界中,回答下列问题:
硫及其化合物广泛存在于自然界中,回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 实验室配制一定物质的量浓度NaCl溶液,用托盘天平秤取5.85gNaCl | |
| B. | 用容量瓶配制溶液时先将容量瓶洗涤并烘干 | |
| C. | 向试管中滴加液体时,胶头滴管紧贴试管内壁 | |
| D. | 酸碱滴定时当指示剂变色后保持半分钟内不变色即达滴定终点 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 洗气瓶中产生的沉淀是碳酸钡 | |
| B. | 洗气瓶中产生的沉淀是硫酸钡 | |
| C. | 在Z导管出来的气体中无二氧化碳 | |
| D. | 反应一段时间后洗气瓶中溶液的酸性减弱 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ?达到化学平衡时?4v正(O2)=5v逆(NO) | |
| B. | ?若单位时间内生成x mol NO的同时消耗x mol NH3?则反应达到平衡状态 | |
| C. | ?达到化学平衡时若增大容器体积,则正反应速率减小,逆反应速率增大 | |
| D. | ?当混合气体的压强不随时间变化时,此反应达平衡 |
查看答案和解析>>
科目: 来源: 题型:解答题
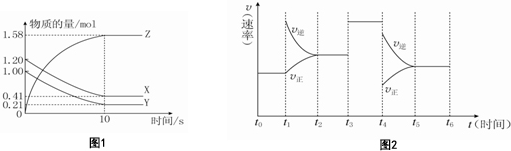
查看答案和解析>>
科目: 来源: 题型:解答题
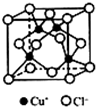 I.下表是A、B、C、D、E五种短周期元素的某些性质:
I.下表是A、B、C、D、E五种短周期元素的某些性质:| A | B | C | D | E | |
| 化合价 | -4 | -2 | -1 | -2 | -1 |
| 电负性 | 2.5 | 2.5 | 3.0 | 3.5 | 4.0 |
| X | Y | Z | |
| 第一电离能/(kJ/mol) | 520.2 | 495.8 | 418.8 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 没有单质参加的化合反应一定是非氧化还原反应 | |
| B. | 金属单质只有还原性,非金属单质只有氧化性 | |
| C. | H2O既有氧化性又有还原性 | |
| D. | KMnO4是一种强氧化剂,没有还原性 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 5 | B. | 6 | C. | 7 | D. | 8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com