
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
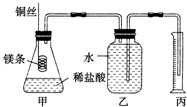 某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答下列问题.该小组设计的简单实验装置如图所示:
某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答下列问题.该小组设计的简单实验装置如图所示:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若T1=T2,则x1>x2 | B. | 若T1=T2,则x1<x2 | C. | 若T1<T2,则x1=x2 | D. | 若T1<T2,则x1<x2 |
查看答案和解析>>
科目: 来源: 题型:选择题
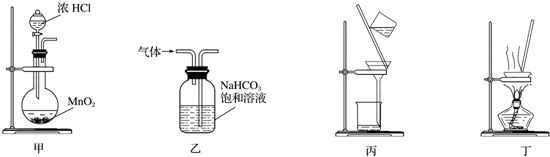
| A. | 用甲装置制取氯气 | B. | 用乙装置除去Cl2中的少量氯化氢 | ||
| C. | 粗盐的提纯过程中用到丙装置 | D. | 用丁装置蒸干溶液制取NH4HCO3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2 mol•L-1 KCl溶液与1 mol•L-1 K2SO4溶液等体积混合后,c(K+)为2 mol•L-1 | |
| B. | 120 g NaCl溶液中溶有20 g NaCl,该温度下NaCl的溶解度为20 g | |
| C. | 22.4 L HCl气体溶于水制成1 L溶液,该溶液的物质的量浓度为1 mol•L-1 | |
| D. | 把5 g胆矾溶于45 g水中,所得溶液溶质的质量分数为10% |
查看答案和解析>>
科目: 来源: 题型:选择题
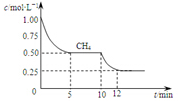 已知:①CO(g)+H2O(g)?H2(g)+CO2(g);△H=-41.2kJ/mol
已知:①CO(g)+H2O(g)?H2(g)+CO2(g);△H=-41.2kJ/mol| A. | △H3=+206kJ/mol | |
| B. | 反应③进行到10min时,改变的外界条件可能是升高温度 | |
| C. | 反应③进行过程中,0~5min这段时间共吸收的热量为103.05kJ | |
| D. | 当反应③平衡后,向容器中通入CH4,平衡向正反应方向移动,CH4的转化率将增大 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 25℃时,1LpH=12的Ba(OH)2溶液中含有的OH-数目为0.02NA | |
| B. | 室温下,14.0g乙烯和丁烯的混合气体中含有的C-H键数目为2NA | |
| C. | 0.1molFe在0.1molCl2中充分燃烧,转移的电子数为0.3NA | |
| D. | 标准状况下,22.4LCCl4中含有的分子数目为NA |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com