
科目: 来源: 题型:选择题
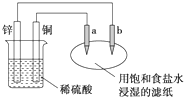
| A. | a为阳极,发生氧化反应:锌为负极被还原 | |
| B. | 电路中电子流动方向:锌→b→a→铜 | |
| C. | 电路中通过0.2mol电子,铜片上产生2.24L气体 | |
| D. | 往滤纸上滴加酚酞,b极附近颜色变红 |
查看答案和解析>>
科目: 来源: 题型:解答题
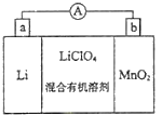 如图是锂锰电池的反应原理示意图,其中电解质KClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中,得到LiMnO2.回答下列问题:
如图是锂锰电池的反应原理示意图,其中电解质KClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中,得到LiMnO2.回答下列问题:查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 溶液中Ca2+的浓度减小 | B. | 溶液质量增大 | ||
| C. | 溶液中Ca(OH)2的质量分数不变 | D. | 溶液中OH-的物质的量不变 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO${\;}_{4}^{2-}$沉淀完全2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| B. | 铝溶于氢氧化钠溶液:Al+2OH-+H2O═AlO2-+H2↑ | |
| C. | 玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2Na++2OH-═Na2SiO3↓+H2O | |
| D. | VO2+与酸性高锰酸钾溶液反应:5VO2++MnO${\;}_{4}^{-}$+H2O═5VO${\;}_{2}^{+}$+Mn2++2H+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硫元素既被氧化又被还原 | |
| B. | 氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 每生成1molNa2S2O3,转移4mol电子 | |
| D. | 相同条件下,每吸收1mol SO2就会放出5.6LCO2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在五水硫酸铜中滴加少量浓硫酸,固体颜色由蓝变白,说明浓硫酸具有吸水性 | |
| B. | 在未知试液中滴加BaCl2溶液得白色沉淀,取该白色沉淀加稀盐酸不溶解,说明原未知试液中含有SO42- | |
| C. | 在铜片上滴加少量稀硫酸,无明显现象,说明稀硫酸没有氧化性 | |
| D. | 某未知气体通入品红溶液中,品红溶液褪色,则原气体一定是 SO2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 从碘水中萃取碘单质,可用苯做萃取剂 | |
| B. | 用加热分解的方法可以区别碳酸钠和碳酸氢钠两种固体 | |
| C. | 配制一定物质的量浓度的NaCl溶液时,只需使用1次玻璃棒 | |
| D. | 氨气喷泉实验时,烧瓶必须干燥才可收集 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
| 装置 | 现象 | 结论及解释 |
 | ①A试管中黑色沉淀逐渐溶解 ②A试管上方出现红棕色气体 ③B试管中出现白色沉淀 | a.现象②说明褐色沉淀具有 还原性. b.试管B中产生白色沉淀的总反应的离子方程式为 NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com