
科目: 来源: 题型:解答题
 .
.
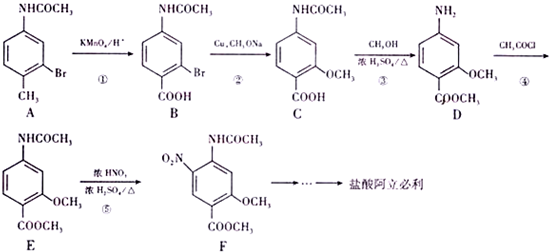
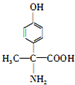
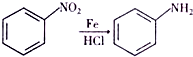 (该物质易被氧化).请写出以
(该物质易被氧化).请写出以 、CH3COCl、CH3OH为原料制备
、CH3COCl、CH3OH为原料制备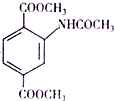 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$H2C═CH2$\stackrel{Hr_{2}}{→}$
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$H2C═CH2$\stackrel{Hr_{2}}{→}$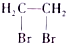
查看答案和解析>>
科目: 来源: 题型:解答题
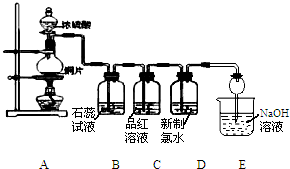 某化学兴趣小组为探究SO2的化学性质,设计了如图所示的装置进行实验.回答下列问题:
某化学兴趣小组为探究SO2的化学性质,设计了如图所示的装置进行实验.回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ②⑤ | B. | ③④⑤ | C. | ①②⑤ | D. | ④⑥ |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验序号 | a | b | c |
| 合金质量/mg | 510 | 765 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 成分 | 质量(g) | 摩尔质量(g/mol) |
| 蔗糖(C12H22O11) | 25.00 | 342 |
| 硫酸钾 | 0.25 | 174 |
| 阿司匹林(C9H8O4) | 0.17 | 180 |
| 高锰酸钾 | 0.25 | 158 |
| 硝酸银 | 0.02 | 170 |
查看答案和解析>>
科目: 来源: 题型:解答题
 霞石是一种硅酸盐,其组成可表示为K2O•3Na2O•4Al2O3•8SiO2.某小组同学设计以霞石为原料制备Al2O3的方案如下:
霞石是一种硅酸盐,其组成可表示为K2O•3Na2O•4Al2O3•8SiO2.某小组同学设计以霞石为原料制备Al2O3的方案如下:查看答案和解析>>
科目: 来源: 题型:解答题
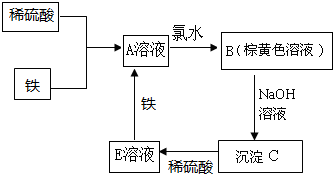 下列物质转化关系如图所示,反应过程中部分产物可能已略去请回答以下问题:
下列物质转化关系如图所示,反应过程中部分产物可能已略去请回答以下问题:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com