
科目: 来源: 题型:选择题
| A. | 原子最外层电子数:X>Y>Z | B. | 离子半径:W3+>Y2- | ||
| C. | 原子序数:X+M>Y+W | D. | 单质沸点:M>Z>Y |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 淀粉 | B. | 蔗糖 | C. | 果糖 | D. | 麦芽糖 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 加入试剂 | 现象 | 反应的离子方程式 | |
| 第一份 | 加入NaOH溶液 | 有白色沉淀生成 | SO2+2OH-═SO32-+H2OBa2++SO32-═BaSO3↓ |
| 第二份 | 加入氯水 | 有白色沉淀生成 | SO2+Cl2+H2O═4H++2Cl-+SO42-Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目: 来源: 题型:选择题
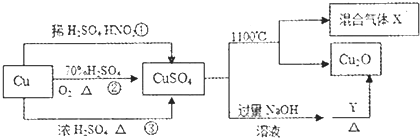
| A. | 途径①、②和③都体现了硫酸的酸性和氧化性 | |
| B. | Y可以是甲醛溶液 | |
| C. | CuSO.在1100℃分解所得气体X可能是SO2和SO3的混合气体 | |
| D. | 将CuSO4溶液蒸发浓缩、冷却结晶,因Cu2+水解得不到胆矾晶体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2O2的电离方程式可写作H2O2?H++HO2-,HO2-?H++O22- | |
| B. | 加水稀释过程中,K1(H2O2)增大,α(H2O2)增大,c(H+)增大 | |
| C. | 加入少量浓盐酸,过氧化氢的电离平衡逆向移动,水的电离平衡逆向移动 | |
| D. | 加入少量氯化铁溶液,溶液中产生大量气泡 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.08 | 0.08 |
| A. | 从反应开始直至60s和80s时,二氧化氮的平均反应速率是相等的 | |
| B. | 80s后将容器的体积缩小为1L,平衡向正反应方向移动,气体颜色变浅 | |
| C. | n1的范围是0.28<n1<0.33 | |
| D. | 升高温度,既能加快反应速率,也能提高N2O4的体积分数 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 单位时间内消耗amol(A),同时消耗3amolC时,反应处于平衡状态 | |
| B. | 增大容器的体积,化学平衡不移动,反应速率也不变 | |
| C. | 升高温度使c(B)增大,可知正反应为放热反应 | |
| D. | 加入催化剂,改变了反应历程,但反应的△H不会变 |
查看答案和解析>>
科目: 来源: 题型:选择题
 中科院大气研究所研究员张仁健课题组与同行合作,对北京地区PM2.5有6个重要来源,其中,汽车尾气和燃煤分别占4%、18%.用于净化汽车尾气的反应为2NO(g)+2CO(g)$\stackrel{催化剂}{?}$ 2CO2(g)+N2(g),已知该反应在570K时平衡常数为1×1059,但反应很慢.下列说法正确的是( )
中科院大气研究所研究员张仁健课题组与同行合作,对北京地区PM2.5有6个重要来源,其中,汽车尾气和燃煤分别占4%、18%.用于净化汽车尾气的反应为2NO(g)+2CO(g)$\stackrel{催化剂}{?}$ 2CO2(g)+N2(g),已知该反应在570K时平衡常数为1×1059,但反应很慢.下列说法正确的是( )| A. | 装有尾气净化装置的汽车排出的气体中不再含有NO或CO | |
| B. | 提高尾气净化效率的常用方法是升高温度 | |
| C. | 增大压强,上述平衡右移,故实际操作中可通过增压的方式提高其净化效率 | |
| D. | 提高尾气净化效率的最佳途径是使用高效催化剂 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2、I2、HI平衡混合气体加压颜色变深 | |
| B. | 氯水光照颜色变浅 | |
| C. | NO2、N2O4混合气体加热颜色变深 | |
| D. | FeCl和KSCN的混合溶液中加入FeCl3固体,溶液颜色加深 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com