
科目: 来源: 题型:选择题
| A. | 用加热、称重的方法鉴别Na2CO3固体和NaHCO3固体 | |
| B. | 用焰色反应鉴别NaCl固体和NaOH固体 | |
| C. | 用KSCN溶液鉴别FeCl3溶液和Fe2(SO4)3溶液 | |
| D. | 检验未知溶液是否含SO42ˉ可先加氯化钡,再加稀盐酸 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
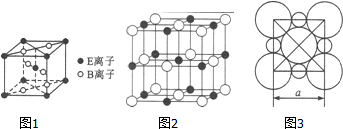 A、B、C、D、E五种常见元素的核电荷数依次增大.A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态3d轨道上有2个电子.请回答下列问题:
A、B、C、D、E五种常见元素的核电荷数依次增大.A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态3d轨道上有2个电子.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
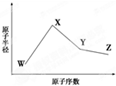 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/ kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加入硝酸酸化,再滴加KSCN溶液后有红色物质生成,则原溶液中一定有Fe3+存在 | |
| B. | 加入盐酸有能使澄清石灰水变浑浊的气体生成,则原溶液中一定有大量的CO32-存在 | |
| C. | 用某溶液做焰色反应实验时火焰为黄色,则该溶液中一定有钠元素,可能有钾元素 | |
| D. | 分别含有Mg2+、Fe3+、Al3+、Cu2+、Fe2+和Na+的六种盐溶液,只用NaOH溶液是不能一次鉴别开的 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A | CH3CH3+Cl2$\stackrel{光照}{→}$CH3CH2Cl+HCl CH2=CH2+HCl→CH3CH2Cl | 均为取代反应 |
| B | 由油脂得到甘油;由卤代烃制醇 | 均发生了水解反应 |
| C | Cl2+2Br?→2Cl?+Br2;Zn+Cu2+→Zn2++Cu | 均为单质被还原的置换反应 |
| D | 2Na2O2+2H2O→4NaOH+O2↑; 2F2+2H2O→4HF+O2 | 均为水作还原剂的氧化还原反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
 A、B、C、D、E、F为元素周期表前四周期的元素,原子序数依次增大,A元素的单质是空气的主要成分,B原子核外p轨道上有1对成对电子,C与B同主族,D元素的价电子数是其余电子数的一半,E与D同族,F与A同主族,回答下列问题:
A、B、C、D、E、F为元素周期表前四周期的元素,原子序数依次增大,A元素的单质是空气的主要成分,B原子核外p轨道上有1对成对电子,C与B同主族,D元素的价电子数是其余电子数的一半,E与D同族,F与A同主族,回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气 | |
| B. | 碳酸钠可作为治疗胃酸过多的药物,食品发酵剂 | |
| C. | 通过丁达尔效应可以鉴别稀豆浆和氢氧化铁胶体 | |
| D. | 焰色反应一定伴随着化学变化和物理过程 |
查看答案和解析>>
科目: 来源: 题型:解答题
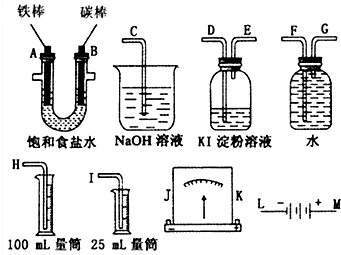 某课外小组做电解食盐水的探究实验,现有如图所示所列实验装置,请从其中选择适当的装置并加以组装,要求检验氯气的氧化性,并测定产生氢气的体积.
某课外小组做电解食盐水的探究实验,现有如图所示所列实验装置,请从其中选择适当的装置并加以组装,要求检验氯气的氧化性,并测定产生氢气的体积.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na+、Fe2+、SO32- | B. | Na+、K+、SO42- | C. | K+、SO42-、OH- | D. | Al3+、NO3-、S2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com