
科目: 来源: 题型:选择题
| A. | 检验某酸性溶液中Cl-和SO42-,选用试剂及顺序是过量Ba(NO3)2溶液、AgNO3溶液 | |
| B. | 将足量CO2和SO2的混合气体分别通入BaCl2溶液、Ba(NO3)2溶液中,最终都无沉淀生成 | |
| C. | 将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中必有铁 | |
| D. | 用加热分解的方法可将NH4Cl固体和Ca(OH)2固体的混合物分离 |
查看答案和解析>>
科目: 来源: 题型:解答题
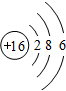 ,
,
查看答案和解析>>
科目: 来源: 题型:选择题
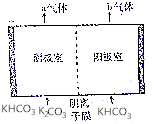 为实现CO2减排,目前较成熟的方法是用碳酸钾溶液为吸收剂捕集工业烟气中的CO2.利用电解法可实现吸收后的溶液(称为富液)的再生.将富液通人阴极室,将KHCO3溶液加入阳极室进行电解,其原理如图所示.下列有关描述不正确的是( )
为实现CO2减排,目前较成熟的方法是用碳酸钾溶液为吸收剂捕集工业烟气中的CO2.利用电解法可实现吸收后的溶液(称为富液)的再生.将富液通人阴极室,将KHCO3溶液加入阳极室进行电解,其原理如图所示.下列有关描述不正确的是( )| A. | 阴极室产生的a气体是H2 | B. | 阳极室产生的b气体是CO2 | ||
| C. | 阴离子从阴极室向阳极室迁移 | D. | 再生液(K2CO3)在阴极室产生 |
查看答案和解析>>
科目: 来源: 题型:选择题
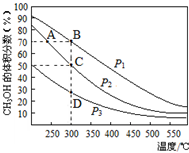 利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)═CH3OH(g).在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示.下列说法正确的是( )
利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)═CH3OH(g).在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示.下列说法正确的是( )| A. | 该反应的△H<0,且p1<p2 | |
| B. | 反应速率:ν逆(状态A)>ν逆(状态B) | |
| C. | 在C点时,CO转化率为75% | |
| D. | 在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数也不同 |
查看答案和解析>>
科目: 来源: 题型:解答题
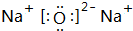 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
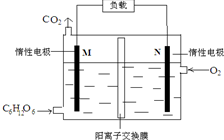 一种新型污水处理装置模拟细胞内生物电的产生过程,可将酸性有机废水的化学能直接转化为电能,下列说法中不正确的是( )
一种新型污水处理装置模拟细胞内生物电的产生过程,可将酸性有机废水的化学能直接转化为电能,下列说法中不正确的是( )| A. | 与等量的C6H12O6完全燃烧放热比较,该装置发电效率高 | |
| B. | 若用该电池电解氧化铝制铝,与N极相连的电极有气体生成 | |
| C. | 电子流向:M→负载→N→电解质溶液→M | |
| D. | 当N极消耗5.6L(标况下)气体时,最多有NA个H+通过阳离子交换膜 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 石油裂解、海水制镁、纤维素制火棉都包含化学变化 | |
| B. | 蛋白质、棉花、聚氯乙烯、淀粉都是自然界存在的天然高分子化合物 | |
| C. | 2013年诺贝尔化学奖授予三位美国化学家,以表彰他们设计出多尺度复杂化学系统模型,将传统化学实验搬到了网络世界,这一完美结合现实与理论的化学系统模型,为全面了解并预测化学反应进程奠定了基础 | |
| D. | 一些有机溶剂(如乙醚、乙醇、苯、丙酮等)沸点低极易被引燃,加热时最好用水浴加热 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | AgCl的溶解度增大 | B. | AgCl的溶解度增大,Ksp不变 | ||
| C. | C(Ag+)增大 | D. | AgCl的溶解度、Ksp均不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com