
科目: 来源: 题型:解答题
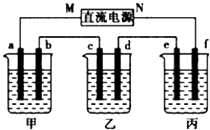 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g500%的NaOH溶液、足量的CuSO4溶液和l00g10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g500%的NaOH溶液、足量的CuSO4溶液和l00g10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 5.6L | B. | 6.72L | C. | 2.8L | D. | 13.44L |
查看答案和解析>>
科目: 来源: 题型:选择题
| 化学式 | CH3COOH | HClO | H2CO3 |
| Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A. | 相同pH的三种酸溶液,物质的量浓度由大到小的顺序为:c(HClO)>c(CH3COOH)>c(H2CO3) | |
| B. | 在相同物质的量浓度的Na2CO3、NaClO、NaHCO3与CH3COONa四种钠盐中加水稀释,水解程度均增大,碱性均增强 | |
| C. | 等物质的量浓度的NaClO和NaHCO3 混合溶液中:c(Na+)=c(HClO)+c(ClO-)+c(HCO3-)+c(CO32-)+c(H2CO3) | |
| D. | 向次氯酸钠溶液中通入少量二氧化碳气体的离子方程式为:2ClO-+CO2+H2O═CO32-+2HClO |
查看答案和解析>>
科目: 来源: 题型:选择题
| 实验 | 温度/K | 起始物质的量/mol | 平衡物质的量/mol | 平衡常数 | |
| CO2 | H2S | H2O | |||
| Ⅰ | 607 | 0.11 | 0.41 | 0.01 | |
| Ⅱ | 607 | 0.22 | 0.82 | ||
| Ⅲ | 620 | 0.1 | 0.4 | 6.74×10-3 | |
| A. | 该反应正反应为吸热反应 | |
| B. | 607K时,把物质的量均为0.1mol四种反应物加入该反应器中,反应将向正反应方向进行 | |
| C. | 实验Ⅱ达到平衡时容器中COS的物质的量为0.02mol | |
| D. | 实验Ⅲ中,无论是开始还是至化学平衡状态,混合气体的密度始终不变 |
查看答案和解析>>
科目: 来源: 题型:解答题
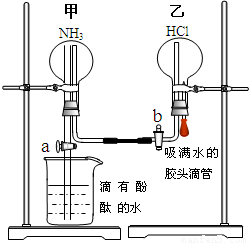 某探究学习小组的同学学习氨的性质以后,为了探究氨气的某些性质,设计并进行了以下实验:
某探究学习小组的同学学习氨的性质以后,为了探究氨气的某些性质,设计并进行了以下实验:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na+ | B. | SO42- | C. | Ba2+ | D. | NH4+ |
查看答案和解析>>
科目: 来源: 题型:选择题
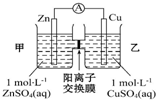
| A. | 铜电极上发生反应Cu-2e-=Cu2+ | |
| B. | 电池工作一段时间后,乙池的c(SO42- )减小 | |
| C. | 电子从锌极经过导线移向铜极 | |
| D. | 电池工作一段时间后,甲池的c(Zn2+ )增加 |
查看答案和解析>>
科目: 来源: 题型:多选题
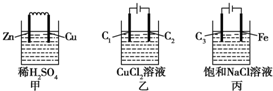
| A. | 甲、丙中是化学能转变为电能,乙中是电能转变为化学能 | |
| B. | C1、C2分别是阳极、阴极,锌片、铁片上都发生氧化反应 | |
| C. | C1上和C3上放出的气体相同,铜片上和铁片上放出的气体也相同 | |
| D. | 甲、乙、丙中溶液的pH都逐渐升高 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 聚氯乙烯分子中含碳碳双键 | |
| B. | 以淀粉为原料可制取乙酸乙酯 | |
| C. | 包装用材料聚乙烯和聚氯乙烯都属于烃 | |
| D. | 油脂的皂化反应属于加成反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向卤代烃水解后的溶液中加入AaNO3溶液,根据沉淀颜色可以判断卤素原子种类 | |
| B. | 银镜反应、乙酸乙酯的水解反应、苯的硝化反应均需水浴加热 | |
| C. | 甲酸酯、葡萄糖、麦芽糖均能发生银镜反应 | |
| D. | 石油催化裂化的主要目的是提高汽油等轻质油的产量与质量;石油裂解的主要目的是为了得到更多的乙烯、丙烯等气态短链烃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com