
科目: 来源: 题型:选择题
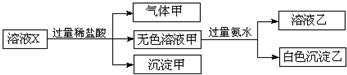 水溶液X中只可能溶有K+、Mg2+、Al3+、AlO2-、SiO32-、SO32-、CO32-、SO42-中的若干种离子.某同学对该溶液进行了如图实验:下列判断正确的是( )
水溶液X中只可能溶有K+、Mg2+、Al3+、AlO2-、SiO32-、SO32-、CO32-、SO42-中的若干种离子.某同学对该溶液进行了如图实验:下列判断正确的是( )| A. | 沉淀甲不一定是纯净物 | |
| B. | 溶液中一定有Al3+和CO32-和SiO32- | |
| C. | K+、AlO2-和SiO32-一定存在于溶液X中 | |
| D. | CO32-和SO42-一定不存在于溶液X中 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
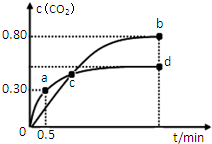
 密闭容器中,反应2X(g)+Y(g)?2Z(g)△H=Q kJ/mol,在不同温度(T1和T2)及压强(P1和P2)下,产物Z的体积分数(φ)与反应时间(t)的关系如图所示.下列判断正确的是( )
密闭容器中,反应2X(g)+Y(g)?2Z(g)△H=Q kJ/mol,在不同温度(T1和T2)及压强(P1和P2)下,产物Z的体积分数(φ)与反应时间(t)的关系如图所示.下列判断正确的是( )| A. | T1<T2,P1<P2,Q>0 | B. | T1>T2,P1>P2,Q>0 | C. | T1>T2,P1>P2,Q<0 | D. | T1<T2,P1<P2,Q<0 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | x+y<z | B. | 平衡向正反应方向移动 | ||
| C. | B的转化率降低 | D. | C的产率不变 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 改变汽车尾气排放压强 | |
| B. | 提高反应温度 | |
| C. | 在尾气排放处使用催化剂 | |
| D. | 向汽车发动机燃烧室中通入过量的空气 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在甲苯中加入少量酸性高锰酸钾溶液,振荡后褪色,正确的解释是由于侧链与苯环的相互影响,使侧链和苯环均易被氧化 | |
| B. | 等质量的乙烷、乙烯、乙炔在氧气中完全燃烧,乙烷消耗的氧气最多 | |
| C. | 间二溴苯仅有一种空间结构可证明苯分子中不存在单双键交替的结构 | |
| D. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 |
查看答案和解析>>
科目: 来源: 题型:解答题
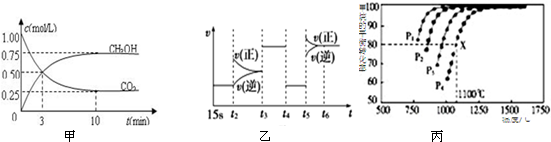
 利用I2O5可消除CO污染或定量测定CO,反应为:5CO(g)+I2O5(s)?5CO2(g)+I2(s);△H 1
利用I2O5可消除CO污染或定量测定CO,反应为:5CO(g)+I2O5(s)?5CO2(g)+I2(s);△H 1查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 正反应为吸热反应,D是固体 | B. | 正反应为吸热反应,D是气体 | ||
| C. | 正反应为放热反应,D是固体或液体 | D. | 正反应为放热反应,D是气体 |
查看答案和解析>>
科目: 来源: 题型:解答题
| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加入氯水后振荡,看水层里是否有棕红色的溴出现 | |
| B. | 加入硝酸银溶液,再加稀硝酸,观察有无浅黄色沉淀生成 | |
| C. | 加入NaOH水溶液共热,冷却后加硝酸银溶液,观察有无浅黄色沉淀生成 | |
| D. | 加入NaOH水溶液共热,冷却后用过量稀硝酸中和过量碱后,再加硝酸银溶液,观察有无浅黄色沉淀生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com