
科目: 来源: 题型:解答题
 铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各 种性能的不锈钢,CrO3大量地用于电镀工业中.
铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各 种性能的不锈钢,CrO3大量地用于电镀工业中.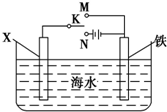 ,可以模拟铁的电化学防护.若 X 为碳棒,为减缓铁的腐蚀,开关 K 应置于N处.若 X 为锌,开关K 置于N或M处.
,可以模拟铁的电化学防护.若 X 为碳棒,为减缓铁的腐蚀,开关 K 应置于N处.若 X 为锌,开关K 置于N或M处.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 只有 Cl2 | B. | 既有 Cl2 又有 O2 | ||
| C. | 只有 O2 | D. | 只有 H2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 相同条件下,2 mol SO2(g)和 1 mol O2(g)所具有的能量小于 2 mol SO3(g)所具有的能量 | |
| B. | 将 2 mol SO2(g)和 1 mol O2(g)置于一密闭容器中充分反应后,放出热量为 Q kJ | |
| C. | 增大压强或升高温度,该平衡都向逆反应方向移动 | |
| D. | 如将一定量 SO2(g)和 O2(g)置于某密闭容器中充分反应放热 Q kJ,则此过程中有 2 mol SO2(g)被氧化 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Cd(OH)2 | B. | Cd(OH)2 | C. | Cd | D. | NiO(OH) |
查看答案和解析>>
科目: 来源: 题型:选择题
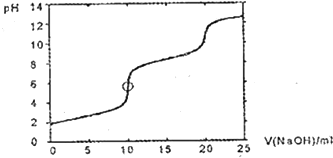
| A. | H2SeO3 | B. | H2SeO3和HSeO3- | C. | HSeO3- | D. | HSeO3-和SeO32- |
查看答案和解析>>
科目: 来源: 题型:选择题
 H2S利用是回收能最并得到单质硫.反应原理为:2H2S(g)+02(g)═S2(s)+2H20(1)△H=-632kJ•mol-1.下图为质子膜H2S燃料电池示意图.下列说法正确的是( )
H2S利用是回收能最并得到单质硫.反应原理为:2H2S(g)+02(g)═S2(s)+2H20(1)△H=-632kJ•mol-1.下图为质子膜H2S燃料电池示意图.下列说法正确的是( )| A. | 该电池可实现把化学能全部转化为电能 | |
| B. | 电极b上发生的电极反应为:02+2H2O+4e-═40H- | |
| C. | 电极a上发生的电极反应为:2H2S-4e-═S2+4H+ | |
| D. | 当有34gH2S参与反应时,有2mo1H+经质子膜进人负极区 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 要完成实验需称取10.6gNa2CO3•10H20晶体 | |
| B. | 本实验需用到的仪器只有药匙、玻璃棒、烧杯、胶头滴管和100 mL容量瓶 | |
| C. | 配制时若容量瓶不干燥,含有少量蒸馏水会导致浓度偏低 | |
| D. | 定容时用胶头滴管滴人的蒸馏水滴在容量瓶内部刻度线上方会导致浓度偏低 |
查看答案和解析>>
科目: 来源: 题型:解答题
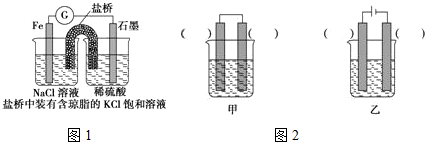
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 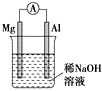 图铝片发生的电极反应式是:Al+4OH-3e-═AlO2-+2H2O | |
| B. |  图发生析氢腐蚀,离子反应方程式为:Fe+2H+═Fe2++H2↑ | |
| C. | 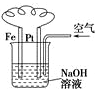 图溶液中发生了变化:4Fe(OH)2+O2+2H2O═4Fe(OH)3 | |
| D. | 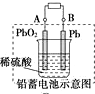 图充电时,阳极反应是:PbSO4+2H2O-2e-═=PbO2+SO42-+4H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com