
科目: 来源: 题型:选择题
| A. | 放电时,负极质量增加 | |
| B. | 放电时,溶液中的BF4-向正极移动 | |
| C. | 充电时,阳极附近溶液的酸性增强 | |
| D. | 充电时,阴极的电极反应式为Pb2+-2e-═Pb |
查看答案和解析>>
科目: 来源: 题型:解答题
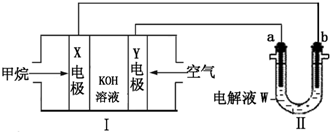
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该混合液中一定含有:K+、NH4+、CO32-、SO42-,可能含Cl- | |
| B. | 该混合液中一定含有:NH4+、CO32-、SO42-,可能含K+、Cl- | |
| C. | 该混合液中一定含有:NH4+、CO32-、SO42-,可能含Mg2+、K+、Cl- | |
| D. | 该混合液中一定含有:NH4+、SO42-,可能含Mg2+、K+、Cl- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 强酸和强碱溶液的反应可以设计成原电池 | |
| B. | 白铁(镀锌铁)破损时与电解质溶液接触,锌被腐蚀 | |
| C. | 电解池内发生的反应均为自发进行的氧化还原反应 | |
| D. | 用惰性电极电解足量饱和食盐水后,可加盐酸使溶液恢复至原状态 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Br-、I-、Cl- | B. | I-、Cl-、Br- | C. | I-、Br-、Cl- | D. | Br-、Cl-、I- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,一定含有SO42- | |
| B. | 观察钾元素焰色反应的操作是:将铂丝放在稀盐酸中洗涤后灼烧至无色,然后再用铂丝蘸取固体氯化钾,置于煤气灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察 | |
| C. | 待检液加入NaOH 溶液并加热,有能使湿润的红色石蕊试纸变蓝的气体生成,则原溶液中一定含有NH4+ | |
| D. | 取少量久置的Na2SO3 样品于试管中加水溶解,再加入足量盐酸有气体产生,然后加入BaCl2 溶液有白色沉淀产生,说明Na2SO3 样品已部分被氧化 |
查看答案和解析>>
科目: 来源: 题型:选择题
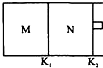 如图所示,隔板K1固定不动,活塞K2可自由移动.T℃时,M、N两个容器中均发生反应N2(g)+3H2(g)?2NH3(g),向容器M、N中各充入l mol N2和3mol H2,初始M、N的容积和温度相同,并保持温度不变.下列说法中不正确的是( )
如图所示,隔板K1固定不动,活塞K2可自由移动.T℃时,M、N两个容器中均发生反应N2(g)+3H2(g)?2NH3(g),向容器M、N中各充入l mol N2和3mol H2,初始M、N的容积和温度相同,并保持温度不变.下列说法中不正确的是( )| A. | 反应达到平衡时N2的转化率:M<N | B. | H2的体积分数:M<N | ||
| C. | NH3的浓度:M<N | D. | 该反应在T℃时的平衡常数K:M=N |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
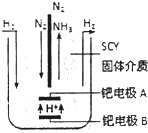 氨和联氨(N2H4)是氮的两种常见化合物,在工农业生产中有重要的应用.
氨和联氨(N2H4)是氮的两种常见化合物,在工农业生产中有重要的应用. [N2H5•H2O]++H+.下列盐酸肼溶液中的离子浓度关系正确的是ac(填序号).
[N2H5•H2O]++H+.下列盐酸肼溶液中的离子浓度关系正确的是ac(填序号).查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 气体A的平衡转化率大于气体B平衡转化率 | |
| B. | 平衡后若减小该体系的压强,则平衡向左移动,化学平衡常数减小 | |
| C. | 物质D的聚集状态一定是气体 | |
| D. | 平衡后升高温度,若平衡向左移动,则正反应的△H>0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com