
科目: 来源: 题型:解答题
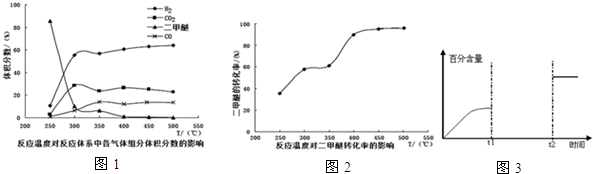
查看答案和解析>>
科目: 来源: 题型:解答题
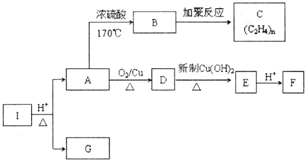 化合物I的分子式为C6H10O4,75%的A溶液常用于医疗消毒,与I相关的反应如图.根据以上信息回答下列问题.
化合物I的分子式为C6H10O4,75%的A溶液常用于医疗消毒,与I相关的反应如图.根据以上信息回答下列问题. .
.查看答案和解析>>
科目: 来源: 题型:解答题
 ,其分子的空间构型为三角锥型.
,其分子的空间构型为三角锥型.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
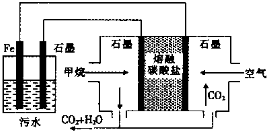
| A. | 左侧装置中的铁电极可换成石墨电极 | |
| B. | 通入甲烷的石墨电极的电极反应式为:CH4+4CO32--8e-═5CO2+2H2O | |
| C. | 通入空气的石墨电极做正极,发生氧化反应 | |
| D. | 若左侧装置中石墨电极产生标准状况下气体44.8L气体,则消耗2mol甲烷 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将亚硫酸钠溶液在空气中蒸干、灼烧,得到的物质的主要成分是亚硫酸钠 | |
| B. | 硝酸亚铁溶液中加入一定量的盐酸可抑制Fe2+的水解,提高Fe2+的浓度 | |
| C. | 室温下OH-浓度相同的醋酸钠和碳酸钠的溶液加水稀释相同的倍数后,碳酸钠溶液的碱性弱 | |
| D. | 25℃,HCN的电离平衡常数Ka=5.0×10-10,同浓度的HCN和NaCN的混合溶液呈酸性 |
查看答案和解析>>
科目: 来源: 题型:选择题
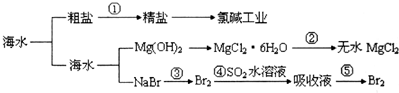
| A. | 第①步中除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 工业上金属钠是通过氯碱工业制取的 | |
| C. | ④和⑤步的目的是为了浓缩 | |
| D. | 第③④⑤步中溴元素均被氧化 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 由此反应可知:还原性HCl>CrCl3 | |
| B. | 每产生3mol Cl2,实际投入的盐酸要大于14mol | |
| C. | 氧化剂和还原剂的物质的量之比为1:6 | |
| D. | 当转移0.3mol电子时,被氧化的还原剂的物质的量为0.7mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下,0.1mol•L-1的醋酸钠溶液中,c2(H+)=Kw-c(CH3COOH)•c(H+) | |
| B. | 常温下,各为0.1mol•L-1的NaHCO3和Na2CO3的混合溶液中:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) | |
| C. | 向氨水中滴加适量的盐酸呈酸性时,不可能有c(Cl-)>c(H+)=c(NH4+)>c(OH-) | |
| D. | 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②④ | B. | ①②③④ | C. | ①②③ | D. | ①③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com