
科目: 来源: 题型:选择题

| A. | 是a mL | B. | 是(50-a)mL | C. | 一定大于a mL | D. | 一定大于(50-a)mL |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | I3-溶液中存在如下平衡:I3-?I2+I- | |
| B. | 在KI3溶液中加入AgNO3溶液,会析出AgI3沉淀 | |
| C. | 向KI3溶液中通入Cl2,溶液颜色会加深 | |
| D. | 配制碘水时,加入KI可增大I2的溶解度 |
查看答案和解析>>
科目: 来源: 题型:选择题
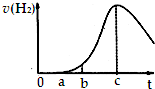 把在空气中久置的铝片5.0g投入盛有 500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如图的坐标曲线来表示,则( )
把在空气中久置的铝片5.0g投入盛有 500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如图的坐标曲线来表示,则( )| A. | 曲线由0→a段发生了氧化还原反应 | |
| B. | 曲线由b→c段,产生氢气的速率增加较快的主要原因是反应放热 | |
| C. | c点达到了平衡 | |
| D. | c点以后,反应逐渐消耗了产生的氢气 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加入适量铜粉除去Cu(NO3)2溶液中的Fe(NO3)3杂质 | |
| B. | 在物质提纯操作中不能用乙醇从碘水中萃取碘 | |
| C. | 向Ca(ClO)2溶液中通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 | |
| D. | 向Ca(OH)2溶液中通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 3:3:2 | B. | 5:5:4 | C. | 2:2:3 | D. | 1:1:1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaOH | B. | FeCl3 | C. | Na2CO3 | D. | Ca(OH)2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 过量SO2通入NaOH溶液中发生SO2+2OH-═SO32-反应 | |
| B. | BF3分子中所有原子都满足最外层8电子结构 | |
| C. | 某元素原子的最外层只有2个电子,则该元素一定是ⅡA族元素 | |
| D. | 使品红溶液褪色,加热后又出现红色的实验能证明SO2气体的存在 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 决定某化学反应反应速率的主要因素是催化剂 | |
| B. | 青霉素、橡胶、阿斯匹林全部由化学合成制得 | |
| C. | 铝有还原性,在反应中放出大量热能用来冶炼难熔金属Mn等 | |
| D. | 陶瓷品、酒精、乙烯塑料等的使用不会对环境造成污染 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氟单质与水反应的化学方程式为F2+H2O═HF+HFO | |
| B. | 碱金属单质在空气中燃烧的生成物都是过氧化物 | |
| C. | x原子的最外层电子数比y原子的少,能说明金属x比金属y的活泼性强 | |
| D. | HCl气体溶于水的过程中,共价键被破坏 |
查看答案和解析>>
科目: 来源: 题型:解答题
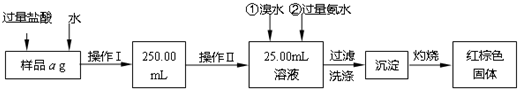
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com