
科目: 来源: 题型:选择题
| A. | 分液、蒸馏、萃取 | B. | 萃取、蒸发、分液 | C. | 分液、萃取、蒸馏 | D. | 蒸馏、萃取、分液 |
查看答案和解析>>
科目: 来源: 题型:解答题
 已知:①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ/mol
已知:①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ/mol| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 危险性 | 危险品 |
| 储运要求 | 远离金属粉末、氨、烃类、醇等物质,设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
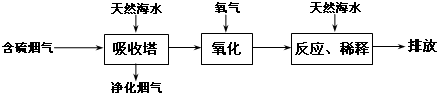
查看答案和解析>>
科目: 来源: 题型:解答题
| 元素 | X | Y | Z | W | R |
| 性质信息 | 能形成+7价的化合物 | 日常生活中常见金属,熔化时并不滴落,好象有一层膜兜着 | 通常状况下能形成短周期中最稳定的双原子分子 | 焰色反应为黄色 | 位于第IVA,是形成化合物种类最多的元素 |

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铝的质量为$\frac{24b-a}{9}$g | |
| B. | c1=$\frac{{c}_{2}{V}_{2}}{{V}_{1}}$ | |
| C. | d=a+34b | |
| D. | 与金属反应后剩余盐酸为(c1V1-2b)mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 混凝剂具有强氧化性 | |
| B. | Al2(OH)nClm•yH2O化学式中m等于3-n | |
| C. | 若(2)中Cl2化学计量数为a,则AgF的化学计量数为3a | |
| D. | 若(2)中AgClO3、O2的化学计量数分别为b、c,则AgCl的化学计量数为5b+4c |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | TiCl4在反应I中是还原产物,在反应Ⅱ中是氧化剂 | |
| B. | C、Mg在反应中均为还原剂,被氧化 | |
| C. | 每生成19.2 g Ti,反应Ⅰ、Ⅱ中共转移1.6 mol e- | |
| D. | 反应I中b=c=2,反应II中Mg的还原性大于Ti |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com