
科目: 来源: 题型:解答题
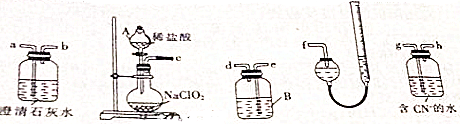

查看答案和解析>>
科目: 来源: 题型:解答题
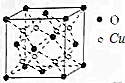 科学家研究发现金属离子吸收氧气的能力十分巨大,人体血液中的血红蛋白依靠亚铁离子结合氧气,其他金属离子(Cu2+、Zn2+等)也可以实现结合和运输氧气的目的.最近丹麦科学家研发了一种晶体材料,该晶体吸收氧气的能力依靠钴离子,它可以让人在水下持久地获得氧气.
科学家研究发现金属离子吸收氧气的能力十分巨大,人体血液中的血红蛋白依靠亚铁离子结合氧气,其他金属离子(Cu2+、Zn2+等)也可以实现结合和运输氧气的目的.最近丹麦科学家研发了一种晶体材料,该晶体吸收氧气的能力依靠钴离子,它可以让人在水下持久地获得氧气.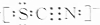 ,则SCN-中σ 键与π键的个数比为1:1.
,则SCN-中σ 键与π键的个数比为1:1.查看答案和解析>>
科目: 来源: 题型:解答题
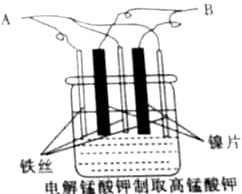 制备KMnO4的最佳方法是电解法,实验室以镍片(不参与反应)和铁丝作电极,电解K2MnO4的水溶液(绿色)制备KMnO4,装置如图:
制备KMnO4的最佳方法是电解法,实验室以镍片(不参与反应)和铁丝作电极,电解K2MnO4的水溶液(绿色)制备KMnO4,装置如图:查看答案和解析>>
科目: 来源: 题型:解答题
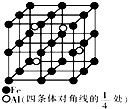 冰晶石(Na3AlF6)是工业上冶炼铝的助熔剂,制取冰晶石(Na3AlF6)的化学方程式为:2Al(OH)3+12HF+3Na2CO3═2Na3AlF6+3CO2↑+9H2O.根据题意完成下列填空:
冰晶石(Na3AlF6)是工业上冶炼铝的助熔剂,制取冰晶石(Na3AlF6)的化学方程式为:2Al(OH)3+12HF+3Na2CO3═2Na3AlF6+3CO2↑+9H2O.根据题意完成下列填空: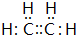
查看答案和解析>>
科目: 来源: 题型:解答题
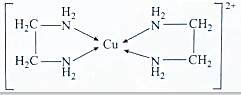
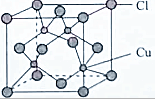
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
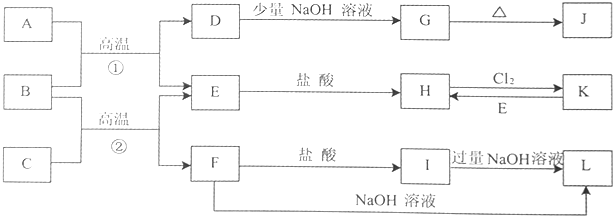
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Al3+和Al(OH)3 | B. | Al(OH)3 | C. | Al(OH)3和AlO2 | D. | AlO2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com