
科目: 来源: 题型:选择题
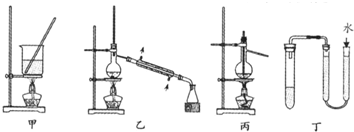
| A. | 用甲装置将海带灼烧成灰 | |
| B. | 分离Na2CO3溶液和CH3COOC2H5,可使用如图乙所示实验装置 | |
| C. | 利用丙装置进行石油分馏 | |
| D. | 利用丁装置检验装置的气密性 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | X2YZ3 | B. | XYZ2 | C. | X2YZ2 | D. | XYZ3 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 基态Mg原子的核外电子排布图: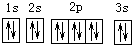 | |
| B. | 过氧化氢的电子式: | |
| C. | As原子的简化电子排布式:[Ar]4s24p3 | |
| D. | 羟基的电子式: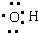 |
查看答案和解析>>
科目: 来源: 题型:解答题
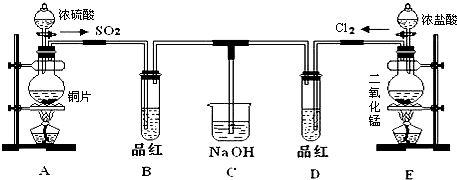
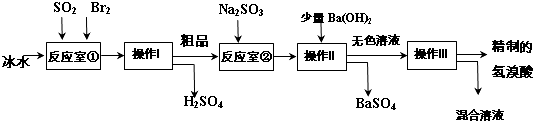
查看答案和解析>>
科目: 来源: 题型:解答题
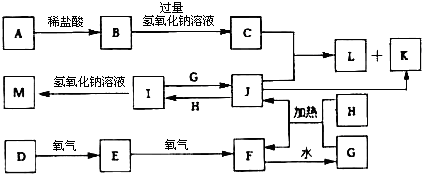
查看答案和解析>>
科目: 来源: 题型:解答题
| 牙膏品牌 | 两面针儿童牙膏 | 珍珠防臭牙膏 | 中华透明牙膏 |
| 摩擦剂 | 氢氧化铝 | 碳酸钙 | 二氧化硅 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向某溶液加入NaOH并微热,产生能够使湿润的红色石蕊试纸变蓝的无色气体,该溶液中一定含有NH4+ | |
| B. | 向某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成,该溶液中一定含有SO42- | |
| C. | 向某溶液中加入氨水,产生白色沉淀,则该溶液中一定含有Mg2+ | |
| D. | 用铂丝蘸取某溶液在酒精灯火焰上灼烧,若火焰呈黄色,则证明该溶液中无K+离子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用食醋去除水垢 | |
| B. | 用竹炭包可清楚衣柜内的异味 | |
| C. | 用铁钉等材料探究铁生锈的条件 | |
| D. | 用柠檬汁涂抹在切开苹果表面可防止苹果变色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com