
科目: 来源: 题型:选择题
| A. | 每一个反应,在一个温度下,有一个K值 | |
| B. | K越大,表示正向反应的倾向大,反应完全 | |
| C. | K值只能说明反应的最大限度,不能说明反应的速度 | |
| D. | 吸热反应的K值大于所有放热反应的K值 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 平衡向正反应方向移动了 | B. | 物质A的转化率减少了 | ||
| C. | 物质B的质量增重了 | D. | a>b |
查看答案和解析>>
科目: 来源: 题型:解答题
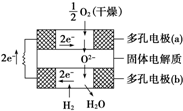 2010年10月上海世博会临近结束的时刻,燃料电池车成为世博会上冉冉升起的新星.燃料电池是一种新型电池,它主要是利用燃料在氧化过程中把化学能直接转化为电能.氢氧燃料电池的突出优点是把化学能直接转变为电能,而不经过热能这一中间形式,它已用于宇宙飞船及潜艇中.
2010年10月上海世博会临近结束的时刻,燃料电池车成为世博会上冉冉升起的新星.燃料电池是一种新型电池,它主要是利用燃料在氧化过程中把化学能直接转化为电能.氢氧燃料电池的突出优点是把化学能直接转变为电能,而不经过热能这一中间形式,它已用于宇宙飞船及潜艇中.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| 序号 | 电极1 | 电极2 | 溶液 |
| A | Cu | Cu | 稀H2SO4 |
| B | Ag | Zn | 稀H2SO4 |
| C | Cu | Cu | 酒精 |
| D | C | C | ZnSO4溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
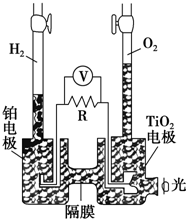 TiO2在光照射下可使水分解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图,电解质溶液为稀硫酸.下列叙述正确的是( )
TiO2在光照射下可使水分解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图,电解质溶液为稀硫酸.下列叙述正确的是( )| A. | 该装置只能将光能转化为电能 | |
| B. | TiO2电极上发生的反应为:2H++2e-═H2↑ | |
| C. | 该装置工作时,电流由TiO2电极经R流向铂电极 | |
| D. | 该装置工作时,TiO2电极附近溶液的pH变小 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题:
次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
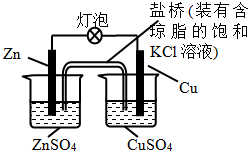
| A. | 一段时间后,铜棒上有红色物质析出 | |
| B. | 正极反应为:Zn-2e-=Zn2+ | |
| C. | 在外电路中,电流从锌棒流向铜棒 | |
| D. | 盐桥中的K+移向ZnSO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com