
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
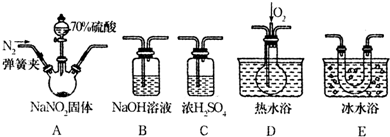
查看答案和解析>>
科目: 来源: 题型:解答题
| 酸 | 电离平衡常数K |
| CH3COOH | 1.76×10-5 |
| H2CO3 | K1=4.3×10-7 K2=5.61×10-11 |
| H3PO4 | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在1 mol CaC2、KHSO4的混合物中含阴、阳离子的总数为3NA | |
| B. | 0.1 mol C2H5OH中所含C-H键的数目为0.6NA | |
| C. | S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA | |
| D. | 78gNa2O2与足量水反应转移的电子数为2NA |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| a | b | c | |
| A | 2 | 1 | 1 |
| B | 1 | 1 | 0 |
| C | 1 | 0 | 1 |
| D | 0 | 1 | 2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
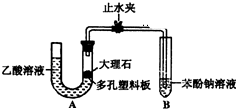 某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.探究乙酸、碳酸和苯酚的酸性强弱关系该校学生设计了如图的实验装置(夹持仪器已略去).
某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.探究乙酸、碳酸和苯酚的酸性强弱关系该校学生设计了如图的实验装置(夹持仪器已略去). -ONa溶液的pH,其pH由大到小排列的顺序为bdac (填溶液编号)
-ONa溶液的pH,其pH由大到小排列的顺序为bdac (填溶液编号)查看答案和解析>>
科目: 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:填空题
用Cl2生产某些含氯有机物时会产生副产物HC1。利用 反应A,可实现氯的循环利用。
反应A,可实现氯的循环利用。
反应A:4HCl+O22Cl2+2H2O
(1)已知:Ⅰ、反应A中, 4mol HCl被氧化,放出115.6kJ的热量。
4mol HCl被氧化,放出115.6kJ的热量。
Ⅱ、
①反应A的热化学方程式是________________________。
②断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差约为__________kJ,H2O中H—0 键比HCl中H—Cl键(填“强”或“弱”)_______________。
(2)合成氨工厂常通过测定反应前后混合气体的密度来确定氨的转化率。某工厂测得合成塔中N2、H2混合气体的密度为0.5536g/L(标准状况),从合成塔中出来的混合气体在相同条件下密度为0.693g/L(标准状况)。该合成氨厂N2的转化率为___________。
查看答案和解析>>
科目: 来源: 题型:选择题
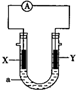
| A. | X为负极,电极反应为:Al-3e-═Al3+ | |
| B. | X为正极,电极反应为:2H2O+O2+4e-═4OH- | |
| C. | Y为负极,电极反应为:Mg-2e-═Mg2+ | |
| D. | Y为正极,电极反应为:2H2O+2e-═2OH-+H2↑ |
查看答案和解析>>
科目: 来源: 题型:填空题
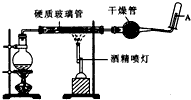 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应. 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”. 请回答该实验中的问题.
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应. 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”. 请回答该实验中的问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com