
科目: 来源: 题型:解答题
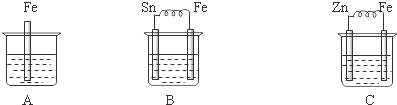
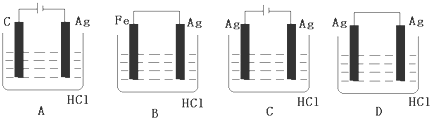
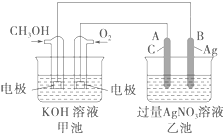
查看答案和解析>>
科目: 来源: 题型:解答题
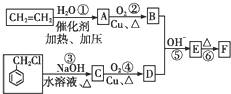
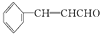 )在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如图路线合成的:
)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如图路线合成的: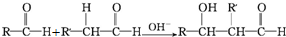
 ;检验其中官能团的试剂为银氨溶液或新制氢氧化铜.
;检验其中官能团的试剂为银氨溶液或新制氢氧化铜. .
. )分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是BCDA(请按实验步骤操作的先后次序填写序号).
)分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是BCDA(请按实验步骤操作的先后次序填写序号).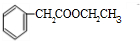
查看答案和解析>>
科目: 来源: 题型:解答题
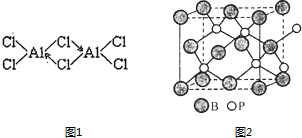 硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途.回答下列问题:
硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途.回答下列问题: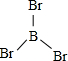 三溴化磷
三溴化磷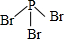
查看答案和解析>>
科目: 来源: 题型:解答题
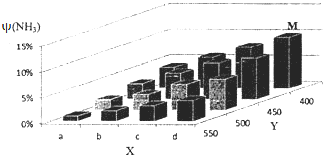 合成氨的工业化生产,解决了世界粮食问题,是重大的化学研究成果.现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用N2(g)+3H2(g)?2NH3(g)△H<0反应模拟哈伯合成氨的工业化生产.当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示.
合成氨的工业化生产,解决了世界粮食问题,是重大的化学研究成果.现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用N2(g)+3H2(g)?2NH3(g)△H<0反应模拟哈伯合成氨的工业化生产.当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 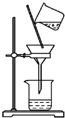 除去粗盐溶液中的不溶物 | B. | 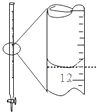 记录滴定终点读数为12.20ml | ||
| C. | 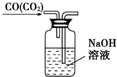 除去CO气体中的CO2气体 | D. | 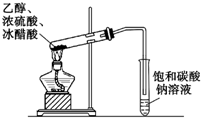 乙酸乙酯制备演示实验 |
查看答案和解析>>
科目: 来源: 题型:填空题
 置换反应的通式可用如图表示,单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:
置换反应的通式可用如图表示,单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原混合溶液中c(K+)为3mol/L | B. | 上述电解过程中共转移4 mol电子 | ||
| C. | 电解得到的Cu的物质的量为0.5mol | D. | 电解后溶液上c(H+)为4 mol/L |
查看答案和解析>>
科目: 来源: 题型:解答题
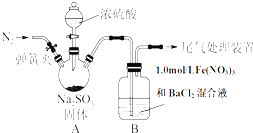 某研究小组为探究SO2和Fe(NO3)3溶液的反应的实质.设计了如图所示装置进行实验.已知:1.0mol/L的Fe(NO3)3溶液的pH=1.
某研究小组为探究SO2和Fe(NO3)3溶液的反应的实质.设计了如图所示装置进行实验.已知:1.0mol/L的Fe(NO3)3溶液的pH=1.查看答案和解析>>
科目: 来源: 题型:解答题
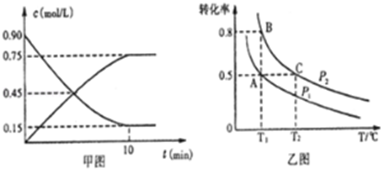
| 温度/℃ | 500 | 525 | 550 | 575 | 600 |
| 平衡转化率/% | 93.5 | 90.5 | 85.6 | 80.0 | 73.7 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com