
科目: 来源: 题型:选择题
| A. | 烷烃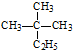 的系统命名为2-甲基-2-乙基丙烷 的系统命名为2-甲基-2-乙基丙烷 | |
| B. | 由石油分馏可以获得石蜡,由石蜡裂化可获得乙烯 | |
| C. | 图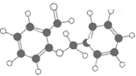 所示的有机物分子式为C14H12O2,能发生银镜反应 所示的有机物分子式为C14H12O2,能发生银镜反应 | |
| D. | 在稀硫酸溶液中,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 将水滴造型与锌块相连 | B. | 将水滴造型与电源的负极相连 | ||
| C. | 将水滴造型与电源的正极相连 | D. | 进行多次人工降雨 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铁与稀硫酸反应 2Fe+6H+═2Fe3++3H2↑ | |
| B. | 氢氧化铝与足量盐酸反应 Al(OH)3+3H+═Al3++3H2O | |
| C. | 钠和冷水反应 Na+2H2O═Na++H2↑+OH- | |
| D. | 铜片与稀硝酸反应 Cu+NO3-+4H+═Cu2++NO↑+2H2O |
查看答案和解析>>
科目: 来源: 题型:解答题
 金属铁晶体为体心立方堆积(如图),实验测得铁的密度为ρ(g•cm-3).已知铁的相对原子质量为a,阿伏加德罗常数为NA(mol-1).
金属铁晶体为体心立方堆积(如图),实验测得铁的密度为ρ(g•cm-3).已知铁的相对原子质量为a,阿伏加德罗常数为NA(mol-1).查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com