
科目: 来源: 题型:选择题
| A. | 等质量的硫磺和硫蒸气分别完全燃烧放出的热量 | |
| B. | 中和体积与pH都相等的醋酸溶液和盐酸所消耗的NaOH的物质的量 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H1 2H2(g)+O2(g)═2H2O(g)△H2,两个反应热△H的大小 | |
| D. | 相同温度、相同浓度的NH4Cl和NH4HSO4溶液中c(NH4+) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 除①④外 | B. | 除②外 | C. | 除⑤外 | D. | 全有关 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 升高温度能使化学反应速率增大,主要原因是降低了反应活化能 | |
| B. | 有气体参加的化学反应,增大压强一定可以增大化学反应速率 | |
| C. | 增大反应物浓度,可提高单位体积内活化分子的百分数,从而使有效碰撞次数增大 | |
| D. | 催化剂的加入能提高单位体积内活化分子百分数,从而增大化学反应速率 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ②⑤ | D. | ⑤⑥ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 由H2、I2蒸气、HI组成的平衡体系加压后颜色变深 | |
| B. | 在沸腾的蒸馏水中滴加饱和FeCl3溶液,制Fe(OH)3胶体 | |
| C. | 开启啤酒瓶后,瓶中立刻泛起大量泡沫 | |
| D. | 用排饱和食盐水的方法收集氯气 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该合金中铜与镁的物质的量之比是1:2 | |
| B. | 该浓硝酸中HNO3的物质的量浓度是14.0 mol•L-1 | |
| C. | NO2和N2O4的混合气体中,NO2的体积分数是80% | |
| D. | 得到2.54 g沉淀时,加入NaOH溶液的体积是640 mL |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,22.4 LHF中分子总数为NA | |
| B. | 室温下,31.0g白磷中含有的共价键数目为1.5NA | |
| C. | 常温常压下,17 g甲基(-14CH3)所含的电子数为9NA | |
| D. | .将1molCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2CO3加在BaCl2前 | B. | Na2CO3加在BaCl2后 | ||
| C. | 同时加 | D. | 无固定顺序 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 饱和H2S溶液 | SnS沉淀完全 | FeS开始沉淀 | FeS沉淀完全 | |
| pH值 | 3.9 | 1.6 | 3.0 | 5.5 |
查看答案和解析>>
科目: 来源: 题型:解答题
 ,它的合成路线如下:
,它的合成路线如下:
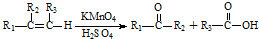
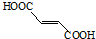 含有的官能团名称为碳碳双键和羧基.
含有的官能团名称为碳碳双键和羧基.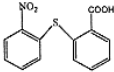 .
. 在一定条件下发生缩聚反应的化学方程式为
在一定条件下发生缩聚反应的化学方程式为 .
.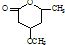 是一种重要的有机化合物.请设计合理方案,完成从
是一种重要的有机化合物.请设计合理方案,完成从 到
到 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com