
科目: 来源: 题型:选择题
| A. | Kb | B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$ | C. | $\frac{c(N{H}_{3}•{H}_{2}O)}{c(O{H}^{-})}$ | D. | n(NH4+) |
查看答案和解析>>
科目: 来源: 题型:解答题
 污鸡净的主要成分是KMnO4和H2C2O4,可用于洗涤有霉斑的衣物.某小组同学拟探究H2C2O4浓度对反应速率的影响.
污鸡净的主要成分是KMnO4和H2C2O4,可用于洗涤有霉斑的衣物.某小组同学拟探究H2C2O4浓度对反应速率的影响.| 实验序号 | 温度/℃ | 各物质的体积/mL | 反应时间 | |||
| H2O | 3mol/L稀硫酸 | 0.1mol/L KMnO4溶液 | 0.6mol/LH2C2O4溶液 | |||
| 1 | 25 | 3.0 | 2.0 | 4.0 | 6.0 | t1 |
| 2 | ① | 5.0 | 2.0 | 4.0 | 4.0 | t2 |
| 3 | 25 | ② | 2.0 | 4.0 | 2.0 | t3 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 目的 | 操作 |
| A | 配制80mL 1.0mol•L-1CuSO4溶液 | 将25g CuSO4•5H2O溶于蒸馏水配制成100mL溶液 |
| B | 除去KCl中少量KClO3 | 将混合物(加少量MnO2)置于坩埚中灼烧至固体质量不再减少 |
| C | 在溶液中将MnO4-完全转化为Mn2+ | 向酸性KMnO4溶液中滴加H2O2溶液至紫色消失 |
| D | 确定NaCl溶液中是否混有Na2CO3 | 取少量溶液滴加CaCl2溶液,观察是否出现白色浑浊 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 汽油失火时,立即用水灭火 | |
| B. | 电线短路失火时,用大量的水灭火 | |
| C. | 浓NaOH 溶液溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液 | |
| D. | 浓硫酸溅到皮肤上,立即用稀 NaOH 溶液洗涤 |
查看答案和解析>>
科目: 来源: 题型:解答题
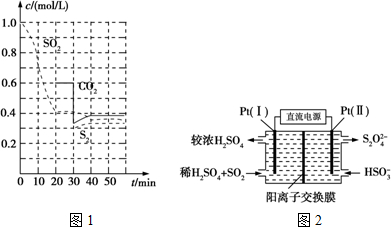
查看答案和解析>>
科目: 来源: 题型:选择题
| 溶质 | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
| A. | 0.1 mol•L-1 Na2CO3溶液中,存在关系:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) | |
| B. | 加热0.1 mol•L-1 NaClO溶液测其pH,pH小于9.7 | |
| C. | pH=2的HF溶液与pH=12的NaOH溶液以等体积混合,则有c(Na+)=c(F-)>c(H+)=c(OH-) | |
| D. | 根据上表数据得出三种酸电离平衡常数大小关系为:HF>HClO>H2CO3(一级电离平衡常数) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O的反应中,生成28 g N2,转移的电子数目为3.75NA | |
| B. | 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA | |
| C. | 氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为4NA | |
| D. | 室温下,1 L pH=13的NaOH溶液中,由水电离的OH-数目为10-13NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com