
科目: 来源: 题型:解答题
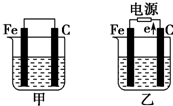 如图所示,甲、乙是电化学实验装置,请回答下列问题:
如图所示,甲、乙是电化学实验装置,请回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| X | Y | |
| Z | W | |
| T |
| A. | 氢化物稳定性Y比W强,是因为Y的氢化物中存在氢键 | |
| B. | XY2、XW2、ZY2熔沸点依次增大,都是由共价键形成的分子晶体 | |
| C. | 一定条件下,X单质能与ZY2反应生成Z单质,说明X的非金属性比Z强 | |
| D. | 根据元素周期律,可以推测T元素的单质具有半导体特性,钠能与T形成Na2T2化合物 |
查看答案和解析>>
科目: 来源: 题型:解答题
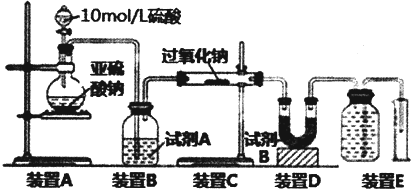
查看答案和解析>>
科目: 来源: 题型:选择题
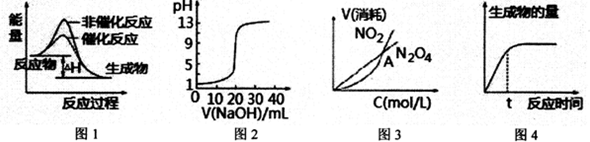
| A. | 图l表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| B. | 图2表示0.1000mol•L-1NaOH溶液滴定20.00mL0.1 000mol•L-1 CH3COOH溶液所得到的滴定曲线 | |
| C. | 图3表示恒温恒容条件下,2NO2(g)?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| D. | 图4表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时v正>v逆 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  | B. | 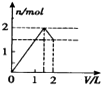 | C. | 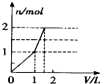 | D. | 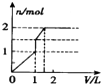 |
查看答案和解析>>
科目: 来源: 题型:解答题
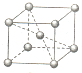 信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门.
信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门.查看答案和解析>>
科目: 来源: 题型:选择题

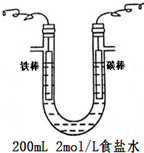
| A. | 制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 | |
| B. | 在镀件上电镀锌,用锌作阳极 | |
| C. | 用如图1装置生产家用消毒液(NaClO) | |
| D. | 用如图2装置为铅蓄电池充 |
查看答案和解析>>
科目: 来源: 题型:解答题
 熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混和气为阴极助燃气,制得在650℃下工作的燃料电池,已知其电池反应相当于CO的燃烧,且负极反应式为2CO+2CO32--4e-=4CO2
熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混和气为阴极助燃气,制得在650℃下工作的燃料电池,已知其电池反应相当于CO的燃烧,且负极反应式为2CO+2CO32--4e-=4CO2查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 化学电源有一次电池、二次电池和燃料电池等,一次电池只能放电,不能充电 | |
| B. | 铅蓄电池应用广泛,是一种常见的可充电电池,放电过程中电解质溶液密度逐渐增大 | |
| C. | 燃料电池具有能量利用率高、可连续使用和污染轻等优点 | |
| D. | 锂电池是一种高能电池,体积小、重量轻,单位质量电极放出的电能多 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com