
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
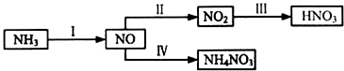
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | a | b | c |
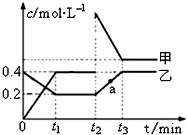
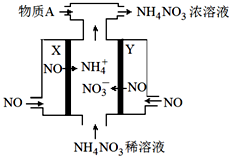
查看答案和解析>>
科目: 来源: 题型:选择题
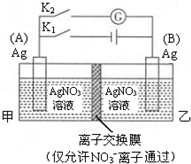
| A. | 闭合K1,断开K2后,A电极增重 | |
| B. | 闭合K1,断开K2后,乙池溶液中Ag+浓度增大 | |
| C. | 断开K1,闭合K2后,B电极发生氧化反应 | |
| D. | 断开K1,闭合K2后,NO3-向A电极移动 |
查看答案和解析>>
科目: 来源: 题型:选择题
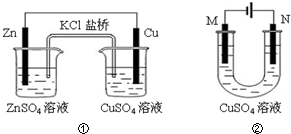
| A. | 装置①中盐桥内的K+移向ZnSO4溶液 | |
| B. | 若装置②中N极为铁棒,M极为石墨,则铁棒不易被腐蚀 | |
| C. | 若装置②用于铁棒镀铜,则M极为铁棒 | |
| D. | 若装置②用于电解精炼铜,则溶液中Cu2+浓度保持不变 |
查看答案和解析>>
科目: 来源: 题型:选择题
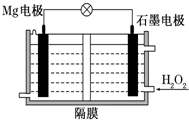 Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法正确的是( )
Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法正确的是( )| A. | Mg电极是该电池的正极 | B. | H2O2在石墨电极上发生氧化反应 | ||
| C. | 石墨电极附近溶液的pH增大 | D. | 电子从石墨电极移向Mg电极 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
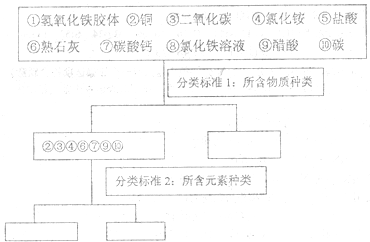
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com