
科目: 来源: 题型:选择题
| A. | 将pH=4 CH3COOH溶液加水稀释10倍,溶液中各离子浓度均减小 | |
| B. | 水电离出来的c(H+)=1.0×10-12mol/L的溶液中,Al3+不可能大量存在 | |
| C. | 0.1mol/L的氨水中滴加稀盐酸至过量,可能有:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 在25℃时,将pH=5的醋酸溶液与pH=9的KOH溶液等体积混合,则充分反应后的混合液:c(CH3COO-)>c(H+)>c(K+)>c(OH-) |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-) | |
| B. | 在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 | |
| C. | 含1 mol KOH的溶液与1 mol CO2完全反应后,溶液中c(K+)=c(HCO${\;}_{3}^{-}$) | |
| D. | 同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7 |
查看答案和解析>>
科目: 来源: 题型:选择题
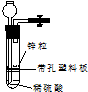 有一兴趣小组准备在实验室中制H2,装置如图所示.可是在实验室中发现酸液不足而又无其他酸液可加入.为达到实验目的,可以从长颈漏斗中加入适量的试剂是( )
有一兴趣小组准备在实验室中制H2,装置如图所示.可是在实验室中发现酸液不足而又无其他酸液可加入.为达到实验目的,可以从长颈漏斗中加入适量的试剂是( )| A. | ①②③ | B. | ②④⑤ | C. | ①②④⑥ | D. | ②③⑥ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硝酸的摩尔质量是63 g | |
| B. | 1 mol CO的质量是28 g | |
| C. | 4 g氢气对应的摩尔质量是2 g氢气对应的摩尔质量的2倍 | |
| D. | 铁的摩尔质量在数值上等于铁原子的相对原子质量 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 摩尔是国际单位制中七个基本物理量之一 | |
| B. | 摩尔是物质的量的单位,简称摩,符号为mol | |
| C. | 摩尔可以把物质的宏观数量与微观粒子的数量联系起来 | |
| D. | 国际上规定,0.012 kg碳原子中所含有的碳原子数目为1摩 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 水、硝酸银溶液、稀硝酸 | B. | 水、氢氧化钠溶液、盐酸 | ||
| C. | 水、氢氧化钾溶液、盐酸 | D. | 水、氢氧化钾溶液、硫酸 |
查看答案和解析>>
科目: 来源: 题型:解答题
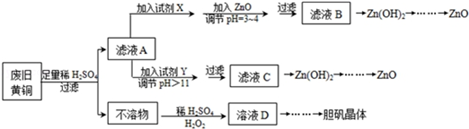
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| s沉淀完全的pH | 3.0 | 8.8 | 8.9 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com