
科目: 来源: 题型:解答题
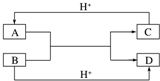 (1)已知A、B、C、D是中学化学中常见的四种不同粒子,它们之间存在如图所示的转化关系(反应条件已经略去):
(1)已知A、B、C、D是中学化学中常见的四种不同粒子,它们之间存在如图所示的转化关系(反应条件已经略去): ;D的结构式:H-O-H.
;D的结构式:H-O-H.查看答案和解析>>
科目: 来源: 题型:选择题
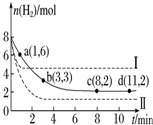 将6mol CO2和8mol H2充入一容积为2L的密闭容器中(温度保持不变)发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0测得H2的物质的量随时间变化如右图中实线所示(图中字母后的数字表示对应的坐标).该反应在8~10min内CO2的平均反应速率是( )
将6mol CO2和8mol H2充入一容积为2L的密闭容器中(温度保持不变)发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0测得H2的物质的量随时间变化如右图中实线所示(图中字母后的数字表示对应的坐标).该反应在8~10min内CO2的平均反应速率是( )| A. | 0.5mol•L-1•min-1. | B. | 0.1mol•L-1•min-1 | ||
| C. | 0 mol•L-1•min-1 | D. | 0.125mol•L-1•min-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 强电解质:盐酸、氢氧化钡、明矾 | |
| B. | 纯净物:冰水混合物;含氧40%的氧化镁 | |
| C. | 有单质参加和单质生成的化学反应一定是氧化还原反应 | |
| D. | 同位素:H2、D2、T2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2:1 | B. | 1:2 | C. | 1:1 | D. | 任意比 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将“地沟油”制成肥皂,可以提高资源的利用率 | |
| B. | 金属钠、金属镁等活泼金属着火时,可以使用泡沫灭火器来灭火 | |
| C. | 我国首艘航母“辽宁舰”上用于舰载机降落的拦阻索是特种钢缆,属于金属材料 | |
| D. | 推广以植物秸秆为原料的综合利用技术,避免焚烧秸秆造成空气污染 |
查看答案和解析>>
科目: 来源: 题型:填空题
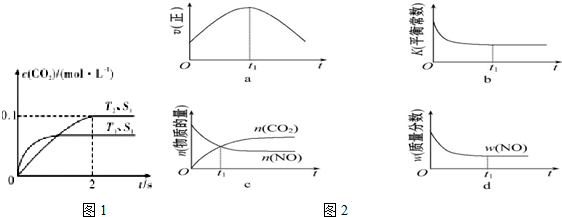
查看答案和解析>>
科目: 来源: 题型:填空题
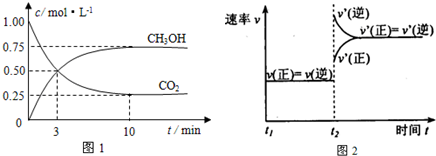
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | SO2、O2分别为0.4mol•L-1、0.2mol•L-1 | |
| B. | SO2为0.25mol•L-1 | |
| C. | SO2、SO3均为0.15mol•L-1 | |
| D. | SO3为0.4mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | SiO2(s)+2C(s)═Si(s)+2CO(g)在常温下不能自发进行,则该反应的△H>0 | |
| B. | 一定条件下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | C(s)+H2O(g)?CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动 | |
| D. | CO(g)的燃烧热是283.0 kJ•mol-1,则CO2分解的热化学方程式为:2CO2(g)═2CO(g)+O2(g)△H=+283.0 kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | KClO3和SO3溶于水后能导电,故KClO3和SO3均为电解质 | |
| B. | 升高温度能够增大单位体积内活化分子百分数,从而加快反应速率 | |
| C. | 中和热测定实验中需要用到的玻璃仪器有烧杯、温度计和量筒三种 | |
| D. | 强电解质的导电能力一定比弱电解质强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com