
科目: 来源: 题型:选择题
| A. | 用铁做阳极材料电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-═Cl2↑ | |
| B. | 碱性甲烷燃料电池的负极反应式:CH3OH-6e-+6OH-═CO2+5H2O | |
| C. | 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-═Cu2+ | |
| D. | 钢铁发生电化学腐蚀的负极反应式:Fe-2e-→Fe2+ |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 该过程中CeO2做催化剂 | |
| B. | 该过程实现了太阳能与化学能的相互转化 | |
| C. | 图中△H1+△H2+△H3﹦0 | |
| D. | 以CO和O2构成的碱性燃料电池的负极反应式为:CO+4OH--2e-═CO32-+2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 等质量的锌粉和锌片与相同体积、相同浓度的盐酸反应,反应速率相等 | |
| B. | 氢气与氮气能够缓慢地反应生成氨气,使用合适催化剂可以提高化学反应的转化率 | |
| C. | 用铁片与硫酸制备氢气时,滴加CuSO4溶液可以加快产生氢气的速率 | |
| D. | 二氧化硫的催化氧化反应的△H<0,所以升高温度,反应速率减慢 |
查看答案和解析>>
科目: 来源: 题型:选择题
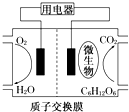
| A. | 该电池不能够在高温下工作 | |
| B. | 电池的负极反应:C6H12O6+6H2O-24e-═6CO2↑+24H+ | |
| C. | 放电过程中,H+会从负极区向正极区迁移 | |
| D. | 在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO2气体$\frac{22.4}{6}$ L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 反应CaO+H2O═Ca(OH)2能放出大量的热,故可通过原电池实现该反应,并把化学能转化为电能 | |
| B. | 在原电池或电解池装置中,都可实现反应:Cu+2H+═Cu2++H2 | |
| C. | 若原电池的两极是活泼性不同的两种金属,则活泼的金属不一定做负极 | |
| D. | 在钢铁制品上镶嵌锌块构成原电池以防治钢铁生锈,这种防护方法叫外加电源阴极保护法 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
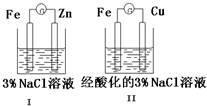
| A. | Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-═4OH- | |
| B. | Ⅰ和Ⅱ中负极反应均是Fe-2e-═Fe2+ | |
| C. | Ⅰ和Ⅱ中正极均被保护 | |
| D. | Ⅰ和Ⅱ中分别加入少量K3[Fe(CN)6]溶液,均有蓝色沉淀产生 |
查看答案和解析>>
科目: 来源: 题型:解答题
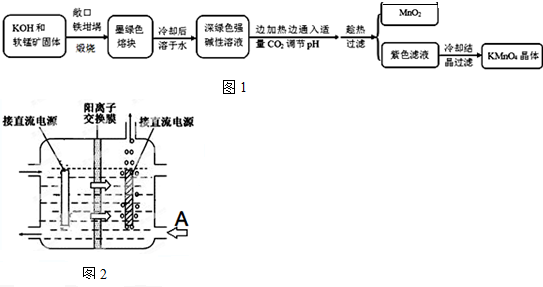
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
查看答案和解析>>
科目: 来源: 题型:解答题
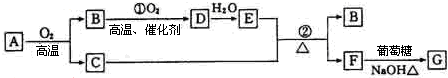
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com