
科目: 来源: 题型:解答题
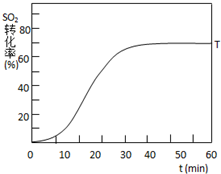 根据当地资源等情况,硫酸工业常用黄铁矿(主要成分为FeS2)作为原料.
根据当地资源等情况,硫酸工业常用黄铁矿(主要成分为FeS2)作为原料.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
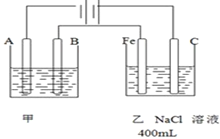
 将洁净的三种金属片X、Y和Z分别放置在浸有食盐溶液的滤纸上并压紧(如图).每次实验时,电压表指针的偏移方向和读数如下表.已知构成两电极的金属,活泼性相差越大,则电压越大.对X、Y、Z和铜四种金属的下列说法,不正确的是( )
将洁净的三种金属片X、Y和Z分别放置在浸有食盐溶液的滤纸上并压紧(如图).每次实验时,电压表指针的偏移方向和读数如下表.已知构成两电极的金属,活泼性相差越大,则电压越大.对X、Y、Z和铜四种金属的下列说法,不正确的是( )| 金属片 | 电子流向 | 电压(V) |
| X | X→Cu | +0.78 |
| Y | Cu→Y | -0.15 |
| Z | Z→Cu | +1.35 |
| A. | Z金属可作为牺牲阳极保护法的阳极,保护Y金属 | |
| B. | Y金属不能从硫酸溶液中置换出氢气 | |
| C. | 三种金属的活泼性顺序为:Y>X>Z | |
| D. | Z和Y能构成电压最大的原电池 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 太阳能电池的主要材料是高纯度的二氧化硅 | |
| B. | 铜锌原电池工作时,电子从铜电极沿外电路流向锌电极 | |
| C. | 铅蓄电池的负极为PbO2,属于二次电池 | |
| D. | 锌锰干电池中,锌电极是负极 |
查看答案和解析>>
科目: 来源: 题型:选择题
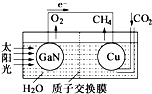 人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.科学家用氮化镓材料与铜组装如图的人工光合系统,成功地实现了以CO2和H2O合成CH4,下列说法不正确的是( )
人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.科学家用氮化镓材料与铜组装如图的人工光合系统,成功地实现了以CO2和H2O合成CH4,下列说法不正确的是( )| A. | 该过程是将太阳能转化为化学能的过程 | |
| B. | GaN表面发生氧化反应,有O2产生 | |
| C. | 电解液中的H+从质子交换膜右侧向左侧迁移 | |
| D. | Cu表面的电极反应式 CO2+8e-+8H+═CH4+2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 处理过程中银器一直保持恒重 | |
| B. | 正极的电极反应为Ag2S-2e-═2Ag++S | |
| C. | 该过程中铝是负极,发生氧化反应 | |
| D. | 黑色褪去的原因是黑色Ag2S转化为白色AgCl |
查看答案和解析>>
科目: 来源: 题型:填空题
| 时间(h) 物质的量(mol) | 0 | 2 | 4 | 6 |
| N2 | 1.50 | 1.20 | 1.00 | 1.00 |
| H2 | 4.50 | 3.60 | 3.00 | 3.00 |
| NH3 | 0 | m | 1.00 | 1.00 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 阳极附近溶液呈红色 | B. | 阳极逸出气体 | ||
| C. | 阴极附近溶液呈蓝色 | D. | 溶液的PH变大 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 平衡向正反应方向移动 | B. | a+b>c+d | ||
| C. | C的体积分数降低 | D. | B的转化率升高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com