
科目: 来源: 题型:解答题
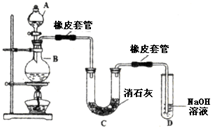 瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体--氯气.某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体--氯气.某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
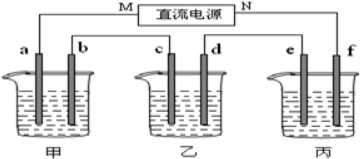
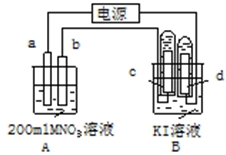 如图装置中:b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡.试回答
如图装置中:b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡.试回答查看答案和解析>>
科目: 来源: 题型:选择题
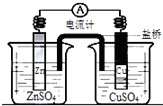
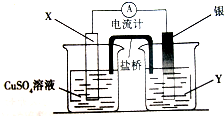
| A. | 铜是阳极,铜片上有气泡产生 | |
| B. | 锌离子在锌片表面被还原 | |
| C. | 正极附近的SO${\;}_{4}^{2-}$离子浓度逐渐增大 | |
| D. | 盐桥中的阳离子会移向CuSO4溶液 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. |  装置所示装置可实现反应:Cu+2H2O$\frac{\underline{\;通电\;}}{\;}$Cu(OH)2+H2↑ | |
| B. | 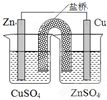 装置能构成锌铜原电池 | |
| C. | 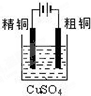 装置可用于粗铜的电解精炼 | |
| D. |  装置可用于在实验室测定中和反应的反应热 |
查看答案和解析>>
科目: 来源: 题型:解答题
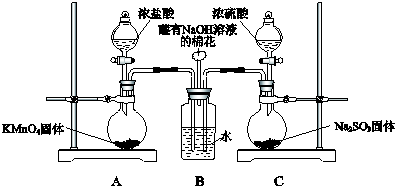
查看答案和解析>>
科目: 来源: 题型:解答题
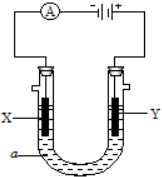 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目: 来源: 题型:解答题
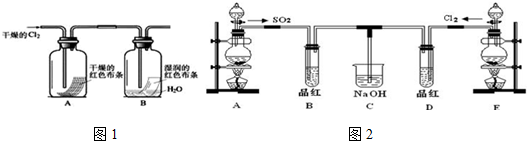
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用碱式滴定管取23.10mL溴水 | |
| B. | 为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可 | |
| C. | 做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸.如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加 | |
| D. | 提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
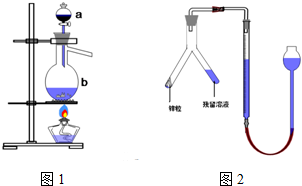
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com