
科目: 来源: 题型:选择题
| A. | 由ZR组成的化合物为离子化合物 | B. | 含氧酸酸性R>X | ||
| C. | X、Y只能共存于共价化合物中 | D. | 原子半径Z>R>Y>X |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 汽油、煤油、植物油均为含碳氢氧三种元素的化合物 | |
| B. | 乙醇、乙酸、乙酸乙酯都能发生取代反应,且都有同分异构体 | |
| C. | 乙酸与丙二酸互为同系物 | |
| D. | 苯能与溴发生取代反应,因此不能用苯萃取溴水中的溴 |
查看答案和解析>>
科目: 来源: 题型:解答题
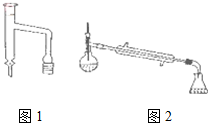 乙酸环己酯具有香蕉及苹果气味,主要用于配制各种饮料、冰淇淋等,实验室制备乙酸环己酯的反应原理、装置示意图和有关数据如下:
乙酸环己酯具有香蕉及苹果气味,主要用于配制各种饮料、冰淇淋等,实验室制备乙酸环己酯的反应原理、装置示意图和有关数据如下: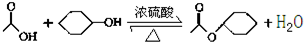
 | 相对分子质量 | 密度/g•cm-3 | 沸点 | 水中溶解性 | |
| 乙酸 | 60 | 1.051 | 118.0 | 溶 | |
| 环己醇 | 100 | 0.962 | 160.8 | 微溶 | |
| 乙酸环己酯 | 142 | 0.969 | 173.5 | 难溶 |
查看答案和解析>>
科目: 来源: 题型:解答题
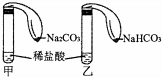 为对比Na2CO3与NaHCO3的性质,实验小组的同学们在甲、乙两支试管中分别加入足量稀盐酸,将两个分别装有Na2CO3或NaHCO3粉末的小气球分别套在两支试管口.将气球内的Na2CO3或NaHCO3倒入试管中(如图).
为对比Na2CO3与NaHCO3的性质,实验小组的同学们在甲、乙两支试管中分别加入足量稀盐酸,将两个分别装有Na2CO3或NaHCO3粉末的小气球分别套在两支试管口.将气球内的Na2CO3或NaHCO3倒入试管中(如图).查看答案和解析>>
科目: 来源: 题型:解答题
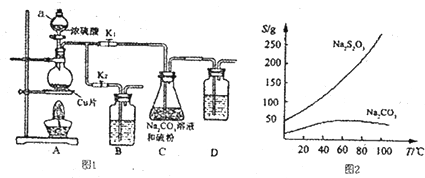
查看答案和解析>>
科目: 来源: 题型:填空题
 如图蓄电池是一种可以反复充电、放电的装置.有一种蓄电池在充电和放电时发生的反应是:NiO2+Fe+2H2O$?_{充电}^{放电}$Fe(OH)2+Ni(OH)2
如图蓄电池是一种可以反复充电、放电的装置.有一种蓄电池在充电和放电时发生的反应是:NiO2+Fe+2H2O$?_{充电}^{放电}$Fe(OH)2+Ni(OH)2查看答案和解析>>
科目: 来源: 题型:解答题
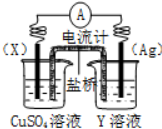
 依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.
依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 使用容量瓶前检查它是否漏水 | |
| B. | 容量瓶用蒸馏水洗净后,再用待配溶液润洗 | |
| C. | 盖好瓶塞,用食指顶住瓶塞,用另一只手指托住瓶底,把容量瓶倒转和摇动几次 | |
| D. | 容量瓶不能长期存放配制好的溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
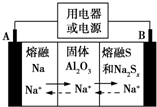 钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示.下列说法正确的是( )
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示.下列说法正确的是( )| A. | 放电时,电极A为负极,Na+由B向A移动 | |
| B. | 放电时,负极反应式为2Na-xe-═2Na+ | |
| C. | 充电时,电极B的反应式为S2--2e-═xS | |
| D. | 充电时,电极B接电源的负极 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Q1=Q2=Q3 | B. | Q2>Q1>Q3 | C. | Q2>Q3>Q1 | D. | Q2=Q3>Q1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com