
科目: 来源: 题型:选择题
| A. | 铝、氧化铝中铝元素微粒的半径r(Al3+)<r(Al) | |
| B. | 工业上可用铝热反应的方法提取镁 | |
| C. | 在铝热反应中化学能全部转化为光能 | |
| D. | 在铝热反应中铁的还原性大于铝的还原性 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 分子式为C3H6O的有机化合物性质相同 | |
| B. | 现在“点石成金”术石墨变成金刚石属于物理变化 | |
| C. | 过氧化钠与水反应成1mol氧气转移4mol电子 | |
| D. | 工业上冶炼铝时加入冰晶石的作用是降低氧化铝的熔融温度 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 质子数为16、中子数为17的硫原子:$\stackrel{17}{16}S$ | |
| B. | 硫离子(S2-)的结构示意图: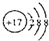 | |
| C. | 二硫化碳分子的结构式:S=C=S | |
| D. | 硫化氢分子的电子式: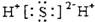 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 提高臭氧浓度以改善空气质量 | B. | 提升矿物燃料的脱硫脱硝技术 | ||
| C. | 研发太阳能汽车代替燃油汽车 | D. | 开发不含氮、磷的洗涤清洁剂 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Al3+、Na+、NO3-、Cl- | B. | K+、Na+、Cl-、NO3- | ||
| C. | K+、Na+、Cl-、AlO2- | D. | K+、NH4+、SO42-、NO3- |
查看答案和解析>>
科目: 来源: 题型:解答题
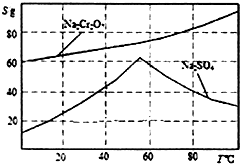 实验室模拟用铬铁矿(主要成分是FeO•Cr2O3)制备红矾钠(Na2Cr2O7•2H20).
实验室模拟用铬铁矿(主要成分是FeO•Cr2O3)制备红矾钠(Na2Cr2O7•2H20).查看答案和解析>>
科目: 来源: 题型:填空题
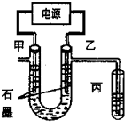 CuCl2溶液中的铜主要以Cu (H2O)42+、CuCl42-形式存在,它们间有如下转化关系:Cu (H2O)42+ (蓝色)+4Cl-?CuCl42- (黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电.下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝.回答下列问题:
CuCl2溶液中的铜主要以Cu (H2O)42+、CuCl42-形式存在,它们间有如下转化关系:Cu (H2O)42+ (蓝色)+4Cl-?CuCl42- (黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电.下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝.回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
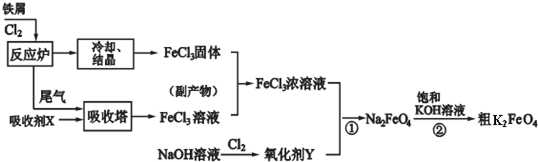
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com