
科目: 来源: 题型:解答题
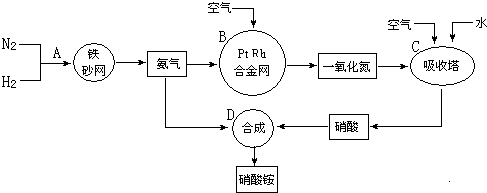

查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
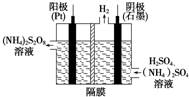 (1)过二硫酸铵法(如图所示)是目前最流行的制备H2O2的方法.即电解含H2SO4、(NH4)2SO4的溶液制取(NH4)2S2O8,再与热水反应即可得H2O2和(NH4)2SO4.
(1)过二硫酸铵法(如图所示)是目前最流行的制备H2O2的方法.即电解含H2SO4、(NH4)2SO4的溶液制取(NH4)2S2O8,再与热水反应即可得H2O2和(NH4)2SO4.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 电解过程中,Na+和SO42-的物质的量浓度保持不变 | |
| B. | 电解过程中,溶液颜色呈现红色→紫色→蓝色的变化 | |
| C. | 阴极产生的气体自始至终只有H2 | |
| D. | 第一阶段中阴、阳两极产生的气体混合引燃后,恰好完全反应得到HCl |
查看答案和解析>>
科目: 来源: 题型:解答题
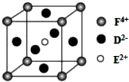 A、B、C、D、E、F是前四周期原子序数依次增大的六种元素.A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同,A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,E元素原子的K、L层电子数之和等于其M、N层电子数之和,F被称为继铁、铝之后的第三金属,可用于制造飞机、火箭、人造卫星、宇宙飞船等领域.请回答下列各题(涉及元素请用相应化学符号表示):
A、B、C、D、E、F是前四周期原子序数依次增大的六种元素.A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同,A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,E元素原子的K、L层电子数之和等于其M、N层电子数之和,F被称为继铁、铝之后的第三金属,可用于制造飞机、火箭、人造卫星、宇宙飞船等领域.请回答下列各题(涉及元素请用相应化学符号表示):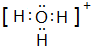 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 4(mol/L) 2 | B. | 16(mol/L) 2 | C. | 20(mol/L) 2 | D. | 25(mol/L) 2 |
查看答案和解析>>
科目: 来源: 题型:解答题
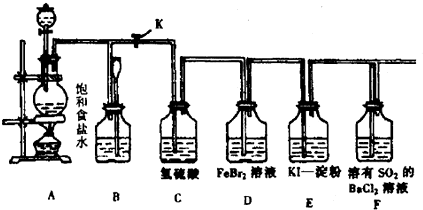
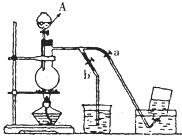 如图表示在没有通风橱的条件下制备氯气时的装置,图中a、b是可控制的弹簧铁夹.(已知:氯气在饱和氯化钠溶液中的溶解度较小.
如图表示在没有通风橱的条件下制备氯气时的装置,图中a、b是可控制的弹簧铁夹.(已知:氯气在饱和氯化钠溶液中的溶解度较小.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子是由原子核和核外电子构成的 | |
| B. | 保持水的化学性质的粒子是水分子 | |
| C. | 分子的质量总比原子的质量大 | |
| D. | 在化学反应中分子可分而原子不可分 |
查看答案和解析>>
科目: 来源: 题型:填空题
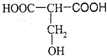 .
. +2H2O;
+2H2O;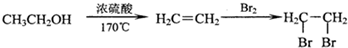
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com