
科目: 来源: 题型:解答题
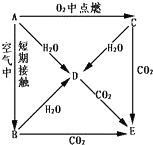 A、B、C、D、E五种物质都含钠元素,它们按图所示关系相互转化,已知A 为单质.
A、B、C、D、E五种物质都含钠元素,它们按图所示关系相互转化,已知A 为单质.查看答案和解析>>
科目: 来源: 题型:选择题
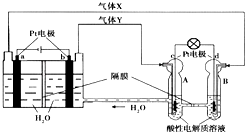 空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池.如图为RFC工作原理示意图,有关说法正确的是( )
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池.如图为RFC工作原理示意图,有关说法正确的是( )| A. | 当有0.1mol电子转移时,a极产生1.12L O2(标况) | |
| B. | b极上发生的电极反应是:2H++2e-═H2↑ | |
| C. | d极上发生的电极反应是:O2+4H++4e-═2H2O | |
| D. | c极上进行还原反应,B中的H+可以通过隔膜进入A |
查看答案和解析>>
科目: 来源: 题型:解答题
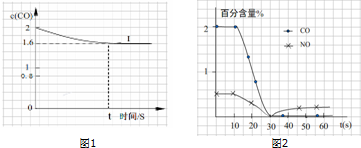
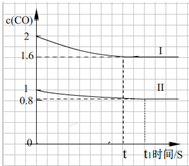 .
.
查看答案和解析>>
科目: 来源: 题型:选择题
 A、B、C三个电解槽,如图所示A中为CuCl2溶液,B、C中均为AgNO3溶液(其中电极的大小、形状、间距均相同),B、C中浓度和体积相同,当通电一段时间后,如若A中铜电极的质量增加1.28g时,B中电极上银增加的质量为( )
A、B、C三个电解槽,如图所示A中为CuCl2溶液,B、C中均为AgNO3溶液(其中电极的大小、形状、间距均相同),B、C中浓度和体积相同,当通电一段时间后,如若A中铜电极的质量增加1.28g时,B中电极上银增加的质量为( )| A. | 4.32 g | B. | 2.16 g | C. | 1.08 g | D. | 0.54 g |
查看答案和解析>>
科目: 来源: 题型:选择题
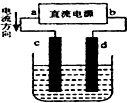
| A. | c、d电极上都有气体产生 | B. | d为阴极、c为阳极 | ||
| C. | d极附近溶液PH值升高 | D. | 电解过程中,氯离子浓度减小 |
查看答案和解析>>
科目: 来源: 题型:解答题
 减少二氧化碳的排放以及资源化利用具有重要意义.
减少二氧化碳的排放以及资源化利用具有重要意义.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 三个烧杯中一定均会发生的离子反应有:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 三个烧杯中钠均在液面上剧烈反应 | |
| C. | Z烧杯中一定会有沉淀生成,但沉淀不是单质铜 | |
| D. | 三个烧杯中生成氢气的物质的量相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com