
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
(2011?宝山区一模)下列实验操作及现象与结论对应关系正确的一组是( )
|
查看答案和解析>>
科目: 来源: 题型:
 (2013?焦作一模)X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物.下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是( ) (2013?焦作一模)X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物.下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是( )
|
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:





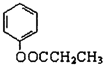

查看答案和解析>>
科目: 来源: 题型:阅读理解
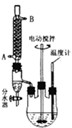 (2013?金华模拟)最常见的塑化剂邻苯二甲酸二丁酯可由邻苯二甲酸酐与正丁醇在浓硫酸共热下反应制得,反应的化学方程式及装置图(部分装置省略)如下:
(2013?金华模拟)最常见的塑化剂邻苯二甲酸二丁酯可由邻苯二甲酸酐与正丁醇在浓硫酸共热下反应制得,反应的化学方程式及装置图(部分装置省略)如下: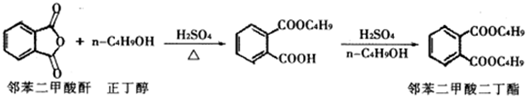


查看答案和解析>>
科目: 来源: 题型:阅读理解
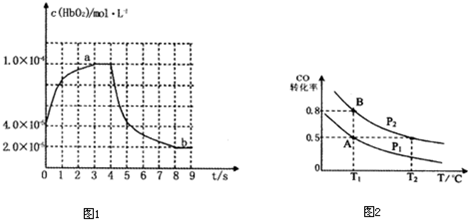
| 1 |
| 10000 |
| 1 |
| 10000 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com