
科目: 来源: 题型:解答题
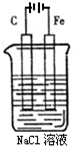 (1)如图是电解NaCl溶液的示意图.请回答下列问题:
(1)如图是电解NaCl溶液的示意图.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
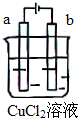
| A. | 电极a表面呈红色 | |
| B. | 电极b表面有气泡生成 | |
| C. | 电子由电源的负极沿导线流向电极b | |
| D. | 该装置能量转化形式为化学能转化为电能 |
查看答案和解析>>
科目: 来源: 题型:选择题
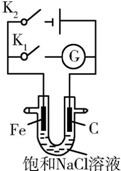
| A. | K1闭合,铁棒上发生的反应为2H++2e-═H2↑ | |
| B. | K1闭合,石墨棒周围溶液的pH逐渐降低 | |
| C. | K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 | |
| D. | K2闭合,电路中通过0.002NA个电子时,两极共产生0.002 mol气体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 当△H为“-”时,表示该反应为吸热反应 | |
| B. | 化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关 | |
| C. | H2S的燃烧热△H=-a kJ•mol-1,则表示H2S燃烧热的热化学方程式为2H2S(g)+3O2(g)═2SO2(g)+2H2O(l)△H=-2a kJ•mol-1 | |
| D. | 反应热的大小与反应物所具有的能量和生成物所具有的能量无关 |
查看答案和解析>>
科目: 来源: 题型:解答题
 铝和硫的单质及其化合物在工农业生产和生活中有重要的作用.
铝和硫的单质及其化合物在工农业生产和生活中有重要的作用.查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后,再将不溶物用稀盐酸溶解去除 | |
| B. | 常温下pH都等于5的CH3COOH溶液和NH4Cl溶液中,水的电离程度前者比后者大 | |
| C. | BaSO4(s)+4C(s)═BaS(s)+4CO(g)室温下不能自发进行,说明该反应的△H<0 | |
| D. | 0.1 mol•L-1CH3COOH溶液加水稀释后,c(OH-)、CH3COOH的电离程度均增大 |
查看答案和解析>>
科目: 来源: 题型:选择题
 最近报道了一种新型可充电式铝电池.电解质为阳离子(EMl+)与阴离子(AlCl4-)组成的离子液体.如图为该电池放电过程示意图,Cn为石墨烯,下列说法不正确的是( )
最近报道了一种新型可充电式铝电池.电解质为阳离子(EMl+)与阴离子(AlCl4-)组成的离子液体.如图为该电池放电过程示意图,Cn为石墨烯,下列说法不正确的是( )| A. | 充电时,每生成1mol Al,电解质溶液中会增加7molAlCl4- | |
| B. | 放电时,电解质中的阳离子(EMl+)未发生反应 | |
| C. | 放电时,负极反应方程式为Al+7AlCl4--3e-═4Al2Cl7- | |
| D. | 充电时,Cn为阳极,电极方程式为Cn+AlCl4--e-═Cn[AlCl4] |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 正极有 O2 逸出 | |
| B. | 铜片上有 H2 逸出 | |
| C. | 电子通过导线由铜片流向锌片 | |
| D. | 正极附近的 SO42- 离子浓度逐渐增大 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氮原子的质量就是氮的相对原子质量 | |
| B. | 氦气的摩尔质量是8g•mol-1 | |
| C. | 1molH2SO4中含1molH2 | |
| D. | 1molH2O的质量是18g |
查看答案和解析>>
科目: 来源: 题型:解答题
 $?_{高温}^{FeSO_{4}/Al_{2}O_{3}}$
$?_{高温}^{FeSO_{4}/Al_{2}O_{3}}$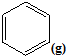 +3H2(g)
+3H2(g)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com