
科目: 来源: 题型:选择题
| A. | SO2具有还原性,可用于蔗糖脱色 | |
| B. | 双氧水具有强氧化性,可用于杀菌消毒 | |
| C. | 铁粉表面积大,可用作食品干燥剂 | |
| D. | SiO2具有导电性,可用于制造光导纤维 |
查看答案和解析>>
科目: 来源: 题型:解答题
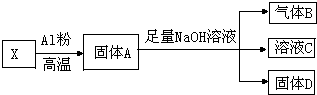 某同学设计实验将Fe3O4和CuO组成的混合物X进行如图所示的转化(每一步均反应完全)
某同学设计实验将Fe3O4和CuO组成的混合物X进行如图所示的转化(每一步均反应完全)查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
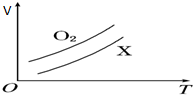 如图表示1g O2与1g X气体在恒压条件下的密闭容器中体积(V)与温度(T)的关系,则X气体可能是( )
如图表示1g O2与1g X气体在恒压条件下的密闭容器中体积(V)与温度(T)的关系,则X气体可能是( )| A. | C2H4 (气) | B. | SO2 | C. | CH4 | D. | NO |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.4mol/L | B. | 0.2mol/L | C. | 0.1mol/L | D. | 0.08mol/L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 金属钠着火时,不能用水来扑灭,可用CO2灭火 | |
| B. | 钠跟CuSO4溶液反应生成的蓝色沉淀上有时会出现暗斑,这是因为析出了金属铜 | |
| C. | 钠在化学反应中常常失去电子被氧化,作氧化剂,故Na+具有强氧化性 | |
| D. | 2.3 g钠与97.7 g水反应后溶液中溶质的质量分数大于4% |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 物质 | 所含杂质 | 除去杂质的方法 |
| A | N2 | O2 | 将气体缓缓通过足量的灼热铜网 |
| B | NaCl | KNO3 | 冷却热饱和溶液,过滤 |
| C | Cu | Zn | 加入足量稀盐酸,充分反应后过滤,洗涤,干燥 |
| D | FeCl2溶液 | CuCl2 | 加入足量铁粉,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
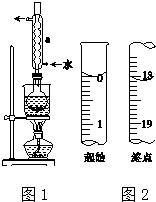 Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
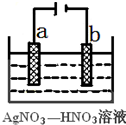 (1)由下列物质冶炼相应金属时采用电解法的是bd.
(1)由下列物质冶炼相应金属时采用电解法的是bd.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com