
科目: 来源: 题型:选择题
| A. | HN3水溶液中微粒浓度大小顺序为:c(HN3)>c(N${\;}_{3}^{-}$)>c(H+)>c(OH-) | |
| B. | HN3与NH3作用生成的叠氮酸铵是离子化合物 | |
| C. | NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N${\;}_{3}^{-}$)>c(OH-)>c(H+) | |
| D. | N${\;}_{3}^{-}$与CO2含相等电子数 |
查看答案和解析>>
科目: 来源: 题型:填空题
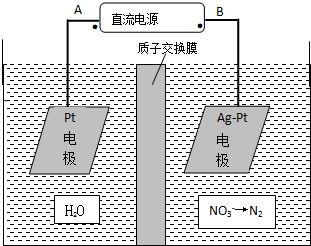 硝酸是一种重要的化工原料,工业上一般以氨气为原料来制备硝酸.请回答:
硝酸是一种重要的化工原料,工业上一般以氨气为原料来制备硝酸.请回答:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用铁作电极电解饱和氯化钠溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| B. | 肥皂水能使酚酞试液变红:C17H35COO-+H2O?C17H35COOH+OH- | |
| C. | FeCl2酸性溶液放在空气中变质:2Fe2++4H++O2═2Fe3++2H2O | |
| D. | 已知苯甲酸的酸性比碳酸强,向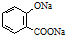 溶液中通入过量CO2: 溶液中通入过量CO2: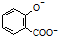 +2CO2+2H2O→ +2CO2+2H2O→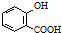 +2HCO3- +2HCO3- |
查看答案和解析>>
科目: 来源: 题型:解答题
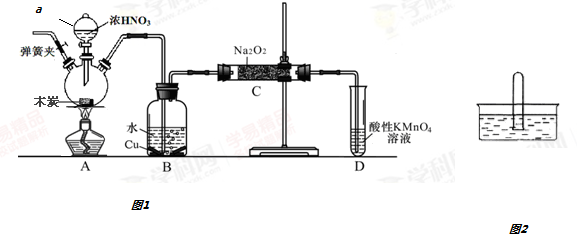
查看答案和解析>>
科目: 来源: 题型:解答题
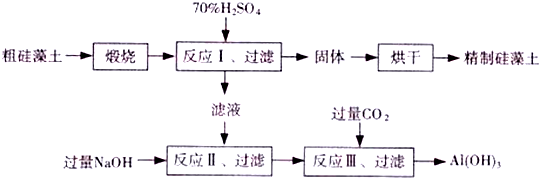
查看答案和解析>>
科目: 来源: 题型:解答题
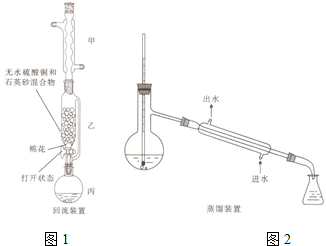 苯甲酸(
苯甲酸(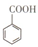 )和乙醇在浓硫酸催化下可以制得苯甲酸乙酯,及时除去反应中产生的水可提高酯的产率.据此某实验小组设计了如下图的装置来进行上述实验.相关信息如下:
)和乙醇在浓硫酸催化下可以制得苯甲酸乙酯,及时除去反应中产生的水可提高酯的产率.据此某实验小组设计了如下图的装置来进行上述实验.相关信息如下:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解度 | |
| 苯甲酸 | 122 | 1.27 | 249 | 微溶 |
| 乙醇 | 46 | 0.789 | 78.3 | 易溶 |
| 苯甲酸乙酯 | 150 | 1.05 | 212.6 | 难溶 |
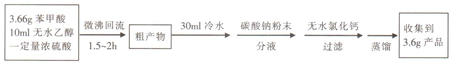
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,22.4L CHCl3含氯原子数为3NA | |
| B. | 100mL 1 mol•L-1醋酸溶液中的氢原子数为0.4NA | |
| C. | 常温常压下,11.2g乙烯中共用电子对数为2.4NA | |
| D. | 6.4 g CaC2晶体中所含的离子总数为0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com