
科目: 来源: 题型:选择题
| A. | 海水中含有丰富的碘元素,故碘被称为“海洋元素” | |
| B. | 溴化银是一种重要的感光材料,也可用于人工降雨 | |
| C. | 钠在盛有氯气的集气瓶中燃烧,火焰呈苍白色,产物为NaCl;铁在盛有氯气的集气瓶中燃烧,火焰呈棕黄色,产物为FeCl3 | |
| D. | 工业炼铁的设备是炼铁高炉,过程中加入石灰石的作用是除脉石(SiO2)造渣 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 过氧化钠与二氧化碳反应中电子转移数为0.2NA | |
| B. | 一定量的C02为0.1NA | |
| C. | 18.4g固体物质为0.lmol Na2C03和0.05molNa202的混合物 | |
| D. | 一定量的Na202为0.lmol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 室温下测定等浓度氨水和NaOH溶液的pH,比较氨水和NaOH碱性强弱 | |
| B. | 将氨水缓慢滴入AlCl3溶液中,研究Al(OH)3的两性 | |
| C. | 将蘸有浓氨水和浓硫酸的玻璃棒靠近,观察到白烟 | |
| D. | 加热除去NH4Cl中的少量NaHC03 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| 甲 | |||
| 丁 |
| A. | 原子半径:丙>丁 | |
| B. | 甲与丁的核外电子数相差10 | |
| C. | 氢氧化物碱性:丙>乙 | |
| D. | 甲、乙的最高价氧化物均是共价化合物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1.8g重水(D2O)中含有的质子数和电子数均为NA | |
| B. | 常温下,O2和O3的混合气体共16g中含有的氧原子数为NA | |
| C. | 标准状况下,22.4L NO和22.4L O2混合后所得气体中分子总数为1.5NA | |
| D. | 将11.2LCl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5NA |
查看答案和解析>>
科目: 来源: 题型:解答题
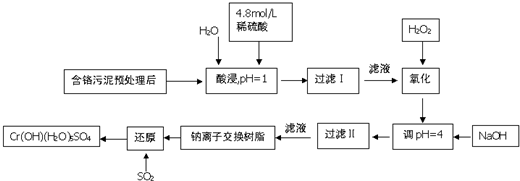
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.0 | - | - | - |
| 沉淀完全是的pH | 3.7 | 9.0 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
科目: 来源: 题型:解答题
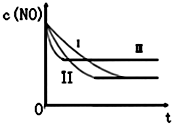 汽车尾气中的主要污染物是NO和CO.为减轻大气污染,人们提出通过以下反应来处理汽车尾气:
汽车尾气中的主要污染物是NO和CO.为减轻大气污染,人们提出通过以下反应来处理汽车尾气:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C(CO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
| 实验 编号 | T/°C | NO初始浓 度/10-3mol•L-1 | CO初始浓 度/10-3mol•L-1 | 催化剂的比 表面积/m2•g-1 |
| ① | 350 | 1.20 | 5.80 | 124 |
| ② | 280 | 1.20 | 5.80 | 124 |
| ③ | 280 | 1.20 | 5.80 | 82 |
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | CO | H2 | |||
| ① | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| ② | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| ③ | 900 | a | b | c | d | t |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O | |
| B. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- | |
| C. | 向0.3mol/LNaClO溶液中滴加等体积的0.2mol/LNaHSO3溶液:2HSO3-+4ClO-═2SO42-+2Cl-+2HClO | |
| D. | 向碘化亚铁溶液中滴加溴的四氯化碳溶液2Br2+2Fe2++2I-═I2+4Br-+2Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com