
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | H2S溶液无法制取H2SO4 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硝酸中,铁丝在浓硫酸中先反应完 |
| C | 离子反应总是向着某种离子浓度减小的方向进行 | 反应2Na+2CH3COOH═2Na++2CH3COO-+H2↑不能进行 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | MgCO3沉淀在水中煮沸,最终转化为Mg(OH)2沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | SO2+2NaOH═Na2SO3+H2O | B. | SO2+H2O+(NH4)2SO3═2NH4HSO3 | ||
| C. | SO2+N02═SO3+NO | D. | SO2+H2O+Br2═H2SO4+2HBr |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 亚硫酸是SO2与水反应的产物,显酸性 | |
| B. | SO2溶于水,剧烈反应生成亚硫酸 | |
| C. | 亚硫酸具有漂白性,能够使品红溶液褪色 | |
| D. | 亚硫酸不稳定,容易分解为水和SO2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下SO3是液体 | |
| B. | 标准状况下,1 mol SO3的体积约为22.4L | |
| C. | SO3与CaO反应生成CaSO3 | |
| D. | SO2遇空气即生成SO3 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
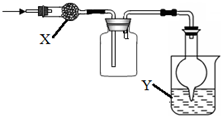 如图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是( )
如图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是( ) | 选项 | X | 收集气体 | Y |
| A | 碱石灰 | 氯气 | 水 |
| B | 碱石灰 | 氨气 | 水 |
| C | 氯化钙 | 二氧化硫 | 氢氧化钠 |
| D | 氯化钙 | 一氧化氮 | 氢氧化钠 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
 CH4、NH3、H20和HF均为含10e-的分子.
CH4、NH3、H20和HF均为含10e-的分子.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com