
科目: 来源: 题型:解答题
 现将一定量的铜片加入到100mL稀硫酸和硫酸铁的混合溶液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化).
现将一定量的铜片加入到100mL稀硫酸和硫酸铁的混合溶液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化).查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 某溶液$\stackrel{+AgNO_{3}溶液}{→}$生成白色沉淀,说明原溶液中含有Cl- | |
| B. | 某溶$\stackrel{+HCl溶液}{→}$无现象$\stackrel{+BaCl_{2}溶液}{→}$生成白色沉淀,+说明原溶液中含有SO42- | |
| C. | 某溶$\stackrel{+NaOH溶液}{→}$生成红褐色沉淀,说明原溶液中含有Fe3+ | |
| D. | 某溶$\stackrel{+稀硫酸}{→}$生成无色气体,说明原溶液中含有CO32- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaOH溶液 | B. | 氨水 | C. | AgNO3溶液 | D. | KSCN溶液 |
查看答案和解析>>
科目: 来源: 题型:解答题
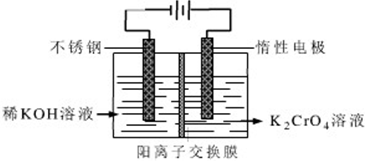
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 已知A、B、C、D、E五种物质,且A、B、C、D的焰色反应均为黄色,它们的关系如下图所示,已知E为气体单质,能使带火星的木条复燃.
已知A、B、C、D、E五种物质,且A、B、C、D的焰色反应均为黄色,它们的关系如下图所示,已知E为气体单质,能使带火星的木条复燃.查看答案和解析>>
科目: 来源: 题型:解答题
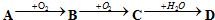
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com