
科目: 来源: 题型:选择题
| A. | 氯化钠的电子式: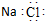 | |
| B. | 苯的结构简式:C6H6 | |
| C. | 硅的原子结构示意图: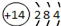 | |
| D. | 硫酸的电离方程式:H2SO4═H2++SO42- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,22.4 LCCl4含有的分子数为NA | |
| B. | 1L0.1 mol•L-1 Na2CO3溶液中含有CO32-数为0.1 NA | |
| C. | 常温常压下,18g水含有的分子数为 NA | |
| D. | 常温下,1mol Cl2与过量NaOH溶液反应,转移电子总数为2NA |
查看答案和解析>>
科目: 来源: 题型:解答题
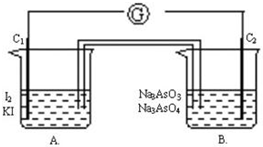 根据可逆反应:AsO43-+2I-+2H+?AsO33-+I2+H2O,设计如下图所示实验装置.
根据可逆反应:AsO43-+2I-+2H+?AsO33-+I2+H2O,设计如下图所示实验装置.查看答案和解析>>
科目: 来源: 题型:解答题
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
查看答案和解析>>
科目: 来源: 题型:解答题
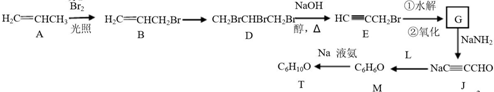
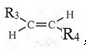 ,则T的结构简式为
,则T的结构简式为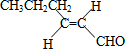 .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 “8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN).请回答下列问题:
“8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN).请回答下列问题: .
.查看答案和解析>>
科目: 来源: 题型:解答题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 生成气体体积/mL | 280 | 336 | 336 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com