
科目: 来源: 题型:选择题
| A. | 放电时,负极发生反应的物质是Li1-xCoO2 | |
| B. | 充电时,阴极发生氧化反应 | |
| C. | 放电时,Li+由负极向正极迁移 | |
| D. | 充电时,阳极的电极反应式为:xLi++nC+xe-=LixCn |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 5:3 | B. | 4:3 | C. | 3:4 | D. | 3:5 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 温度实验次数 | 起始温度t2 /℃ | 终止温度 t2 /℃ | 温度差平均值 (t2- t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 25.0 | 25.2 | 25.1 | 28.5 | 3.4 |
| 2 | 24.9 | 25.1 | 25.0 | 28.3 | 3.3 |
| 3 | 25.6 | 25.4 | 25.5 | 29.0 | 3.5 |
查看答案和解析>>
科目: 来源: 题型:选择题
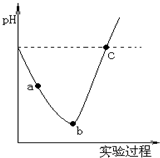 在常温下,取一定量的蒸馏水,然后将Cl2缓慢通入水中至饱和,再向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
在常温下,取一定量的蒸馏水,然后将Cl2缓慢通入水中至饱和,再向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )| A. | 实验进程中可用pH试纸测定溶液的pH | |
| B. | 向a点所示溶液中能入SO2,溶液的酸性和漂白性均增强 | |
| C. | 由a点到b点的过程中,溶液中c(H+)/c(ClO-)减小 | |
| D. | c点所示的溶液中,c(Na+)=c(ClO-)+c(Cl-) |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
 硼化钒(VB2)、空气电池是目前储电能力最高的电池,电池示意图如图.该电池的反应产物分别是V2O5和B的最高价氧化物.下列说法正确的是( )
硼化钒(VB2)、空气电池是目前储电能力最高的电池,电池示意图如图.该电池的反应产物分别是V2O5和B的最高价氧化物.下列说法正确的是( )| A. | 图中选择性透过膜应只允许阴离子通过 | |
| B. | 电池工作过程中a电极附近溶液pH减小 | |
| C. | VB2电极发生的电极反应为:2VB2+11H2O-22e-═V2O5+2B2O3+22H+ | |
| D. | 如果负载为氯碱工业装置,外电路中转移0.1mol电子,则阴极生成气体1120mL |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向NaHSO4溶液中滴加Ba(OH)2溶液至中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 向饱和Na2CO3溶液中通入足量CO2:2Na++CO32-+CO2+H2O═2NaHCO3↓ | |
| C. | 向Ca(HCO3)2溶液中加入足量Ca(OH)2溶液:Ca2++HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 向次氯酸溶液中滴加NaOH溶液:H++OH-═H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 46g乙醇中含有共价键的数目为7NA | |
| B. | 50ml 2mol•L-1NaClO溶液中ClO-数目为0.1NA | |
| C. | 标准状况下,5.6gFe与足量的浓硫酸充分反应,转移电子数为0.2NA | |
| D. | 常温常压下,4.4g由CO2和N2O组成的混合气体所含原子总数为0.3NA |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
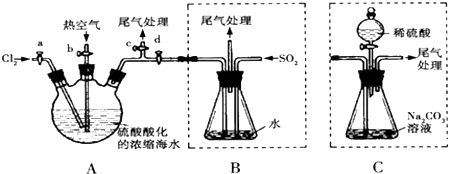
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com