
科目: 来源: 题型:选择题
| A. | 构成原电池的电极是两种不同的金属 | |
| B. | 原电池是将化学能转化为电能的装置 | |
| C. | 原电池负极发生的电极反应是还原反应 | |
| D. | 原电池的正极是还原剂,总是溶液中的阳离子在此被还原 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 第七周期第IIIA族 | B. | 第七周期第VA族 | ||
| C. | 第七周期第IIIB族 | D. | 第七周期第VB族 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、OH-、Cl-、SO42- |
查看答案和解析>>
科目: 来源: 题型:选择题
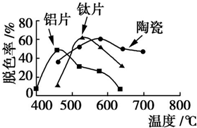 在不同的载体(钛片、铝片、陶瓷)表面制备TiO2薄膜,探究不同载体下TiO2薄膜光催化使甲基橙脱色的效果,每光照20min取一次样,实验结果如图所示.下列说法正确的是( )
在不同的载体(钛片、铝片、陶瓷)表面制备TiO2薄膜,探究不同载体下TiO2薄膜光催化使甲基橙脱色的效果,每光照20min取一次样,实验结果如图所示.下列说法正确的是( )| A. | 不同载体,无论何种温度一定是钛片载体的光催化活性最好 | |
| B. | 无论何种载体,催化活性总是随温度的升高而升高 | |
| C. | 约在520℃时,钛片载体的光催化活性最好 | |
| D. | 不同载体,TiO2薄膜的光催化活性相同 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | +2 | B. | +1 | C. | 0 | D. | -2 |
查看答案和解析>>
科目: 来源: 题型:解答题
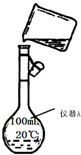 化学是一门以实验为基础的学科,化学所取得的丰硕成果,是与实验的重要作用分不开的.结合右侧下列实验装置图回答有关问题:
化学是一门以实验为基础的学科,化学所取得的丰硕成果,是与实验的重要作用分不开的.结合右侧下列实验装置图回答有关问题:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
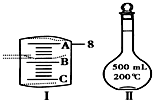 实验室要用NaCl晶体配制500mL 0.2mol•L-1NaCl溶液,回答下列问题:
实验室要用NaCl晶体配制500mL 0.2mol•L-1NaCl溶液,回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
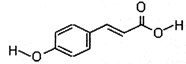
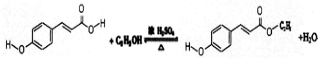 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com