
科目: 来源: 题型:解答题
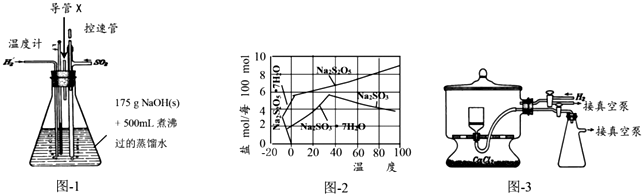
查看答案和解析>>
科目: 来源: 题型:选择题
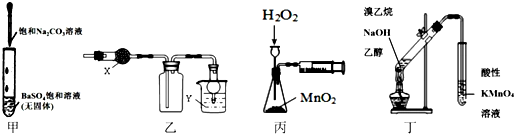
| A. | 甲可用于研究沉淀的转化,可比较出Ksp(BaSO4>Ksp(BaCO3) | |
| B. | 乙中X为无水CaCl2,Y为NaOH溶液时,该装置可用于SO2的收集 | |
| C. | 丙装置可定量测定H2O2的分解速率 | |
| D. | 丁可用于证明实验中生成了乙烯 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 配制银氨溶液时的总反应:Ag++3NH3•H20═[Ag(NH3)2]OH+NH4++2H20 | |
| B. | 向1 mL 0.l mol/L硝酸亚铁溶液加入1 mL 0.1 mol/L的HI溶液:3 Fe2++N03-+4H+═3 Fe3++NO+2H2O | |
| C. | 向10 mL 0.lmol/L NH4Al(SO4)2溶液中加入0.1 mol/L Ba(OH)2溶液至恰好只有一种沉淀时:NH4++Al3++5OH-+2 SO42-+2Ba2+═AlO2-+NH3•H2O+2H2O+2BaSO4L | |
| D. | 向高锰酸钾酸性溶液中滴加H202溶液,高锰酸钾溶液紫红色褪去:2MnO4-+7H2O2+6H+═2Mn2++6O2+lOH2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | l mol H20最多可形成氢键数目为2NA | |
| B. | 标准状况下,11.2 L甲醛所含的σ键数目为2NA | |
| C. | 常温下,46 g N02所含分子数目为NA | |
| D. | pH=l的硫酸中所含S042-的数目为0.05NA |
查看答案和解析>>
科目: 来源: 题型:解答题
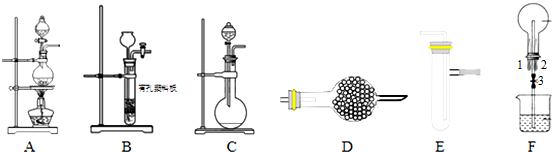
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 5.4 g | B. | 8.4 g | C. | 4.1g | D. | 9.6g |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CO+H2O(g)═CO2+H2 | B. | 3NO2+H2O═2HNO3+NO | ||
| C. | 2Na2O2+2H2O═4NaOH+O2↑ | D. | 2F2+2H2O═4HF+O2 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | Zn+H2SO4═ZnSO4+H2↑ | B. | 2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑ | ||
| C. | S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2 | D. | H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com