
科目: 来源: 题型:选择题
| A. | 一定有SO2、NH3和NO | B. | 一定有NO和HCl | ||
| C. | 可能有Cl2和O2 | D. | 一定没有Cl2、NO2、NH3和O2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.05molNa2O2固体中含有的阴离子数均为0.05NA | |
| B. | 标准状况下,2.24LCH4所含的原子数为0.1NA | |
| C. | 1molSO2与足量O2在一定条件下反应,共转移2NA个电子 | |
| D. | 1L0.1mol/L氨水中含有的NH3•H2O分子数为0.1NA |
查看答案和解析>>
科目: 来源: 题型:解答题
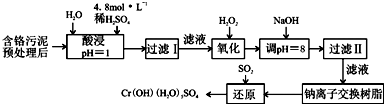
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | -- | -- | 4.7 | -- |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 (>9溶解) |
查看答案和解析>>
科目: 来源: 题型:解答题
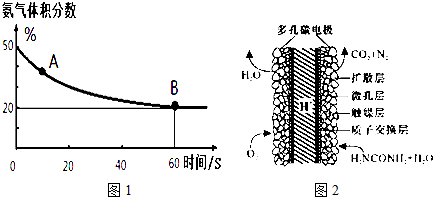
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | a通入CO2,然后b通入NH3,c中放碱石灰 | |
| B. | a通入NH3,然后b入CO2,c中放蘸稀硫酸的脱脂棉 | |
| C. | b通入NH3,然后a通入CO2,c中放碱石灰 | |
| D. | b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 25.4ρ | B. | 12.7ρ | C. | 6.97ρ | D. | 6.35ρ |
查看答案和解析>>
科目: 来源: 题型:选择题
| 滴定 次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 25.00 | 0.20 | 20.22 |
| 第二次 | 25.00 | 0.56 | 24.54 |
| 第三次 | 25.00 | 0.42 | 20.40 |
| A. | 0.0853mol/L | B. | 0.1000mol/L | C. | 0.0800mol/L | D. | 0.1250mol/L |
查看答案和解析>>
科目: 来源: 题型:选择题
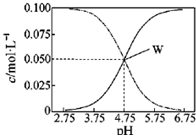 25℃,有c(CH3COOH)+c(CH3COO-)=0.l mol/L的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示.有关离子浓度关系分析正确的是( )
25℃,有c(CH3COOH)+c(CH3COO-)=0.l mol/L的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示.有关离子浓度关系分析正确的是( )| A. | pH=5.5溶液中:c(CH3COO->c(CH3COOH)>c(H+)>c(OH一) | |
| B. | W点表示溶液中:c(Na+)=c(CH3COO-) | |
| C. | pH=3.5溶液中:c(Na+)-c(OH-)+c(CH3COOH)=0.l moL/L | |
| D. | 向W点所表示溶液中通入0.05molHCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-) |
查看答案和解析>>
科目: 来源: 题型:解答题

 ②
②
 (请用化学方程式表达).
(请用化学方程式表达). 等(任写一种).
等(任写一种).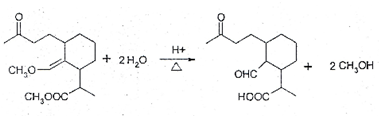 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com